题目内容
【题目】用下列实验装置进行相应实验,不能达到实验目的是( )
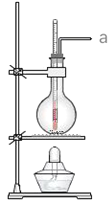
A. 图1:实验室制备Fe(OH)2
图1:实验室制备Fe(OH)2
B. 图2:收集NO气体
图2:收集NO气体
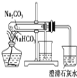
C.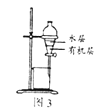 图3:所示装置分离CCl4萃取溴水后已分层的有机层和水层
图3:所示装置分离CCl4萃取溴水后已分层的有机层和水层
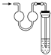
D. 图4:可证明NH4NO3溶解时需要吸收热量
图4:可证明NH4NO3溶解时需要吸收热量
【答案】A
【解析】
A.Fe作阴极,不能失去电子,则图中Fe与电源负极相连,不能制备![]() ,故A符合题意;
,故A符合题意;
B.NO与二氧化碳不反应,短进长出可排出二氧化碳,则图中装置可收集NO,故C不符合题意;
C.四氯化碳的密度比水大,在混合液的下层,可用图示的分液装置分离,故C不符合题意;
D.硝酸铵溶于水后,锥形瓶中温度降低、压强减小,导致玻璃管左侧液面上升,可证明![]() 溶解时需要吸收热量,故D不符合题意;
溶解时需要吸收热量,故D不符合题意;
答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】根据下列5种元素的电离能数据![]() 单位:
单位:![]()
元素符号 |
|
|
|
|
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
V | 420 | 3100 | 4400 | 5900 |
它们的氯化物的化学式,最可能正确的是
A.![]() B.RClC.
B.RClC.![]() D.TCl
D.TCl
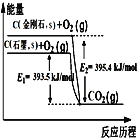
【题目】Ⅰ.当今社会,能源的发展已成为全世界共同关注的话题,乙烷、二甲醚的燃烧热较大,可用作燃料。如图1表示乙烷、二甲醚燃烧过程中的能量变化。

请回答下列问题:
(1)a=______。
(2)乙烷的燃烧热为______。
(3)等物质的量的C2H6(l)比C2H6(g)完全燃烧生成稳定的氧化物时放出的热量______(填“多”或“少”)。
(4)根据题图写出二甲醚完全燃烧时的热化学方程式:________。
(5)从环保角度分析,放出相同的热量时选择_______(填“乙烷”或“二甲醚”)作为燃料产生的二氧化碳较少。
Ⅱ.利用如图2装置测定中和热的实验步骤如下:

①用量筒量取50mL0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL0.55mol/L NaOH 溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)大小烧杯中填充泡沫塑料的作用是_______。
(2)倒入NaOH溶液的正确操作是_______(从下列选出)。
A.一次迅速倒入 B.分三次少量倒入 C.沿玻璃棒缓慢倒入
(3)使硫酸与 NaOH 溶液混合均匀的正确操作是_______。
(4)实验数据如下表:
温度实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ①_______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 29.8 | ||
②近似认为0.55mol/LNaOH溶液和0.25mol/L 硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=______(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol 有偏差,产生偏差的原因可能是________(请答出两条)。