题目内容
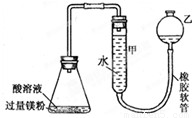
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.( 1 )装置中有刻度的甲管可以用 代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同.装置如图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH0.1 mol/L40.00mL | HCl溶液 0.1 mol/L 40.00mL | 5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| … | … | … | ||
①每次实验至少需要用电子天平(能称准1mg) 称取镁粉 g;
②冷却到25℃后,在读取气体体积时,首先应如何操作: ;
③分析实验数据,t(a1)远远大于t(b1)的原因是 .
(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为mg的镀锌铁皮与6mol?L-1 NaOH溶液反应.回答下列问题:(已知锌的密度为 ρ g/cm3)
①写出Zn镀层与NaOH溶液反应的离子方程式
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入 (填仪器名称)
实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③已知实验前后甲管中液面读数差为V mL.则镀锌铁皮的锌镀层厚度为 cm.(写出数学表达式)
(2)①根据酸和金属之间的关系式计算;
②冷却到25℃后,在读取气体体积时,要使甲乙两管中液面相平时再读数;
③物质的量浓度大小影响化学反应速率进而会影响化学反应的时间;
(3)①锌的性质和铝的性质相似,根据氢氧化铝和氢氧化钠的反应方程式写出氢氧化锌和氢氧化钠溶液的反应方程式;
②用分液漏斗向锥形瓶内加入氢氧化钠溶液,利用产生气体产生的压强时氢氧化钠溶液滴下;
③根据氢气和锌之间的关系式计算.
解答:解:( 1 )装置中有刻度的甲管可以用碱式滴定管代替;检查装置的气密性装置气密性检验有多种方法,原理都是根据装置内外的压强差形成水柱或气泡,其操作方法为:向乙中注入适量的水,使乙中液面高于甲中液面,静止观察,若液面差保持不变,则气密性良好,
故答案为:碱式滴定管,向乙中注入适量的水,使乙中液面高于甲中液面,静止观察,若液面差保持不变,则气密性良好;
(2)①根据酸和金属之间的关系式得镁的质量=
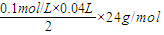 =0.048g,
=0.048g,故答案为:0.048;
②冷却到25℃后,在读取气体体积时,要使甲乙两管中液面相平时再读数,如果液面不相平,则液体产生压强,对测量结果有影响,
故答案为:上下移动乙管,使甲管中液面和乙管中液面相平,再读数;
③醋酸是弱酸,电离程度很小,盐酸是强酸,所以开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+],所以a1的反应速率小于b1,即t(a1)远远大于t(b1),
故答案为:开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+);
(3)①锌的性质和铝的性质相似,根据氢氧化铝和氢氧化钠的反应方程式知,氢氧化锌和氢氧化钠溶液反应的离子方程式为:Zn+2OH-+2H2O=Zn(OH)42-+H2↑,
故答案为:Zn+2OH-+2H2O=Zn(OH)42-+H2↑;
②用分液漏斗向锥形瓶内加入氢氧化钠溶液,利用产生气体产生的压强时氢氧化钠溶液滴下,所以另一孔插入分液漏斗,故答案为:分液漏斗;
③设锌片的厚度为hcm,根据转移电子相等得,锌和氢气之间的关系式为:
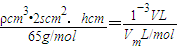 ,h=
,h=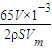 cm,
cm,故答案为:
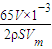 .
.点评:考查对实验原理与操作步骤的理解及评价、化学计算、物质组成的测定等,难度较大,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键,注意锌的厚度计算时锌的面积是2s而不是s,为易错点.

 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案右下图装置可用于多项定量实验。图中夹持固定装置已略去,甲有刻度,供量气用。

( 1 )装置中有刻度的甲管可以用______________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是______________________________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同。装置如右图所示,
有关实验数据记录于下表:
|
酸溶液 |
酸溶液 |
气体体积/mL |
反应时间 |
|
|
(实验A) |
(实验B) |
(25℃、101 kPa) |
实验A |
实验B |
|
CH3COOH 0.1 mol/L 40.00mL |
HCl溶液 0.1 mol/L 40.00mL |
5 |
t(a1)=155 s |
t(b1)=7 s |
|
10 |
t(a2)=310 s |
t(b2)=16 s |
||
|
15 |
t(a3)=465 s |
t(b3)=30 s |
||
|
20 |
t(a4)=665 s |
t(b4)=54 s |
||
|
…… |
…… |
…… |
请回答下列问题:
①每次实验至少需要用电子天平(能称准1 mg) 称取镁粉___________________g;
②冷却到25℃后,在读取气体体积时,首先应如何操作:__________________________;
③分析实验数据,t(a1)远远大于t(b1)的原因是__________________________。
(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为m g的镀锌铁皮与6mol·L—1 NaOH溶液反应。回答下列问题:(已知锌的密度为 ρ g/cm3)
① 写出Zn镀层与NaOH溶液反应的离子方程式________________________________________
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入______(填仪器名称)
实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③ 已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol·L—1)。则镀锌铁皮的锌镀层厚度为_________________________cm。(写出数学表达式)
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
( 1 )装置中有刻度的甲管可以用________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同.装置如图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH0.1 mol/L40.00mL | HCl溶液 0.1 mol/L 40.00mL | 5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| … | … | … | ||
①每次实验至少需要用电子天平(能称准1mg) 称取镁粉________g;
②冷却到25℃后,在读取气体体积时,首先应如何操作:________;
③分析实验数据,t(a1)远远大于t(b1)的原因是________.
(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为mg的镀锌铁皮与6mol?L-1 NaOH溶液反应.回答下列问题:(已知锌的密度为 ρ g/cm3)
①写出Zn镀层与NaOH溶液反应的离子方程式________
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入________(填仪器名称)
实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol?L-1).则镀锌铁皮的锌镀层厚度为________cm.(写出数学表达式)
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
 s
s ________。
________。