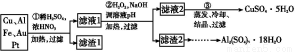
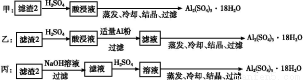
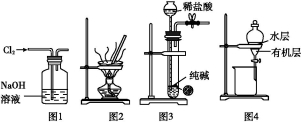
题目内容
某新型碱性可充电电池,能长时间保持稳定的放电电压。该电池的总反应为3Zn+2K2FeO4+8H2O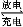 3Zn(OH)2+2Fe(OH)3+4KOH,以下说法错误的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,以下说法错误的是( )
A.电池放电是化学能转化成电能的过程
B.放电时正极反应为:Fe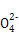 +4H2O+3e-
+4H2O+3e- Fe(OH)3+5OH-
Fe(OH)3+5OH-
C.充电时电池的负极接外电源的正极
D.充电时电解质溶液中的阴离子向阳极定向移动
C
【解析】A选项符合原电池定义,正确;放电时正极反应是氧化剂得电子的反应,B选项正确;放电时,电池负极流出电子,而充电时应流入电子,接外电源负极,C选项错;充电时,阴离子移向阳极,完成导电过程,D选项正确。

 快捷英语周周练系列答案
快捷英语周周练系列答案某无色溶液中只可能含有①Na+、②Ba2+、③Cl-、④I-、⑤S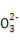 、⑥S
、⑥S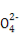 离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表。下列结论正确的是( )
离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表。下列结论正确的是( )
步骤 | 操作 | 现象 |
① | 用pH试纸检验 | 溶液的pH大于7 |
② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈紫红色 |
③ | 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
A.肯定含有的离子是③④⑤
B.肯定没有的离子是②⑤
C.不能确定的离子是③⑥
D.可能含有的离子是①⑥
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下表(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大:
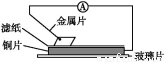
金属 | 电子流动方向 | 电压/V |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.25 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
依据记录数据判断,下列结论中正确的是( )
A.将甲、乙形成的合金露置在空气中,甲先被腐蚀
B.金属乙能从硫酸铜溶液中置换出铜
C.在四种金属中丙的还原性最弱
D.甲、丁若形成原电池时,甲为正极
苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
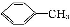 +2KMnO4
+2KMnO4
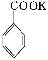 +KOH+
+KOH+
2MnO2↓+H2O
 +HCl
+HCl
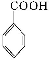 +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
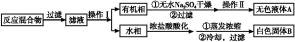
已知:苯甲酸分子量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体B加入水中,加热溶解, | 得到白色晶体和无色滤液 |
|
② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体, |
| 白色晶体 是苯甲酸 |
(4)纯度测定:称取1.220 g产品,配成100 mL甲醇溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3 mol。产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。