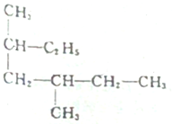
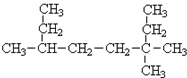题目内容
18.A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去).
试回答:
(1)若X是强氧化性单质,则A不可能是de
a.C b.N2 c.Na d.Mg e.Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为FeCl3;C溶液在贮存时应加入少量X,理由(用离子方程式和必要的文字说明)2Fe3++Fe=3Fe2+、防止Fe2+被氧化.
(3)若X为化合物,A、B、C为含金属元素的无机化合物,A溶液与C溶液反应生成B.则X的可能为NaOH或CO2(填化学式),A溶液与C溶液反应生成B的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓或HCO3-+OH-=H2O+CO32-.
分析 (1)若X是强氧化性单质,根据转化关系,A可发生连续氧化,则A为S或C、Na或N2;
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有氯离子,则X为Fe,A为氯气,B为氯化铁,C为氯化亚铁,氯化亚铁在空气中容易被空气中的氧气氧化;
(3)若X为化合物,A、B、C均为含有同种金属元素的化合物,A溶液与C溶液反应生成B,则A为AlCl3,X为NaOH,B为Al(OH)3,C为NaAlO2,氯化铝与偏铝酸钠发生双水解得氢氧化铝,以此来解答.
解答 解:(1)若X是强氧化性单质,根据转化关系,A可发生连续氧化,则A为S或C、Na或N2,故答案为:de;
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有氯离子,则X为Fe,A为氯气,B为FeCl3,C为FeCl2,氯化亚铁在空气中容易被空气中的氧气氧化,所以氯化亚铁溶液贮存时要加入少量铁粉,反应的离子方程式为2Fe3++Fe=3Fe2+,
故答案为:FeCl3;2Fe3++Fe=3Fe2+;防止Fe2+被氧化;
(3)若X为化合物,A、B、C均为含有同种金属元素的化合物,A溶液与C溶液反应生成B,则A为AlCl3,X为NaOH,B为Al(OH)3,C为NaAlO2,氯化铝与偏铝酸钠发生双水解得氢氧化铝,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,或者X为CO2,A为NaOH,B为Na2CO3,C为NaHCO3,A、C反应的离子方程式为HCO3-+OH-=H2O+CO32-,
故答案为:NaOH或CO2;Al3++3AlO2-+6H2O=4Al(OH)3↓或HCO3-+OH-=H2O+CO32-.
点评 本题考查无机物的推断,本题侧重于元素化合物知识,明确物质的性质是解本题关键,熟悉常见物质的性质即可解答,题目难度中等.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 4.8g石墨中的共价键数目 | |
| B. | 250mL1mol•L-1FeCl3溶液中,阴、阳离子总数 | |
| C. | 一定条件下,将1mol SO2和0.5molO2充入一密闭容器内,充分反应后的生成物分子数 | |
| D. | 在反应KClO4+8HCl═KCl+4Cl2↑+4H2O中,生成0.5 molCl2转移的电子数 |
| A. | 用托盘天平称取150kg的食盐 | B. | 用pH试纸测得某溶液的pH为6.72 | ||
| C. | 用普通温度计测得室温为34.68℃ | D. | 用10mL量筒量取7.5mL水 |
| A. | 常温时,NaHCO3溶液的pH值比同浓度的CH3COONa溶液小 | |
| B. | 常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均降低 | |
| C. | 把FeCl3和FeCl2溶液分别蒸干并灼烧最后都得到Fe2O3 固体 | |
| D. | 以酚酞作指示剂,用相同浓度的盐酸滴定等体积等浓度的NaOH溶液和氨水,消耗盐酸的体积相同 |
| A. | 得0.20mol NaCl和0.08mol NaHCO3 | |
| B. | 剩0.04mol Na2CO3,得0.20mol NaCl | |
| C. | 剩0.06mol HCl,得0.14mol NaCl和0.14mol NaHCO3 | |
| D. | 得0.06mol NaCl和0.08mol NaHCO3 |
| X | ||
| Y | Z | W |
| T |
| A. | X、W、Z 元素的气态氢化物的热稳定性均依次递减 | |
| B. | Y、Z、W 元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增 | |
| C. | 液态WX3 气化均需克服分子间作用力 | |
| D. | 根据元素周期律,可以推测T 元素的单质具有半导体的特性 |
 如图所示为中学化学实验中几种常见仪器的部分结构:
如图所示为中学化学实验中几种常见仪器的部分结构: