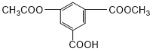
题目内容
【题目】观察![]() Cl-粒子,完成下列问题:
Cl-粒子,完成下列问题:
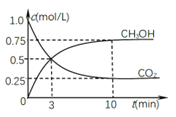
(1)所含质子数________,中子数________,电子数________,质量数________。
(2)该元素的最高正化合价是________。
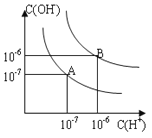
(3)该粒子的结构示意图________________,电子式________________。
(4)该粒子与![]() Cl的半径大小的关系是________________。
Cl的半径大小的关系是________________。
【答案】17 18 18 35 +7 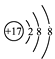
![]()
![]() Cl->
Cl->![]() Cl
Cl
【解析】
![]() Cl-表示的是质子数为17、中子数为35-17=18、带一个单位负电荷的氯离子。
Cl-表示的是质子数为17、中子数为35-17=18、带一个单位负电荷的氯离子。
(1)![]() Cl-所含质子数为17,中子数为18,电子数=质子数+1=17+1=18,质量数为35。
Cl-所含质子数为17,中子数为18,电子数=质子数+1=17+1=18,质量数为35。
(2)该元素的原子电子数为17,原子结构示意图为 ,最外层有7个电子,所以其最高正化合价是+7价。
,最外层有7个电子,所以其最高正化合价是+7价。
(3)![]() Cl-的结构示意图为
Cl-的结构示意图为 ,电子式为
,电子式为![]() 。
。
(4)![]() Cl-比
Cl-比![]() Cl多了一个电子,所以半径比
Cl多了一个电子,所以半径比![]() Cl稍大,故半径大小的关系是
Cl稍大,故半径大小的关系是![]() Cl->
Cl->![]() Cl。
Cl。

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目