题目内容
19. 如图是甲烷燃料电池原理示意图,回答下列问题:
如图是甲烷燃料电池原理示意图,回答下列问题:①电池的负极是a(填“a”或“b”),该极的电极反应是:CH4-8e-+10OH-═CO32-+7H2O.
②电池工作一过程中正极pH增大,负极pH值减小,一段时间后电解质溶液的pH减小(填“增大”、“减小”或“不变”).
分析 ①燃料电池中,通入燃料的电极是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据电池反应式以及电极反应式确定溶液pH变化以及电极附近pH的变化.
解答 解:①燃料电池中,通入燃料的电极是负极,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,所以a电极是负极,电极反应式为CH4-8e-+10OH-═CO32-+7H2O,故答案为:a;CH4-8e-+10OH-═CO32-+7H2O;
②在碱性溶液中,通入燃料的电极是负极,负极电极反应式为CH4-8e-+10OH-═CO32-+7H2O,消耗氢氧根离子,所以负极pH减小,正极上是氧气得电子的还原反应:O2+2H2O+4e-=4OH-,正极pH增大,甲烷燃料电池的总反应式为CH4+2O2+2OH-=CO32-+3H2O,溶液中氢氧根离子被消耗,导致溶液的pH减小,故答案为:增大;减小;减小.
点评 本题考查了原电池原理,根据金属失电子难易、物质得失电子确定原电池正负极,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,难度中等.

练习册系列答案
相关题目
10.一种无色气体100mL,由NH3、NO、CO2所组成,将此无色气体通过浓硫酸的洗气瓶后,发现气体减少了30mL.剩余气体继续通过Na2O2固体后,发现气体变成红棕色,再将该气体通入盛满水倒立于水槽中的试管内,发现试管内水位上升,最后试管内充满液体.则原混合气体中NH3、NO、CO2气体的体积比为( )
| A. | 5:8:12 | B. | 15:14:21 | C. | 10:14:21 | D. | 30:28:23 |
14.下列实验基本操作及注意事主要出于安全考虑的是( )
| A. | 实验剩余的药品不能放回原试剂瓶 | B. | 酒精灯内酒精不能少于灯容积$\frac{1}{4}$ | ||
| C. | 实验结束后将试管清洗干净 | D. | 胶头滴管不能交叉使用 |
8.活性炭可处理大气污染物NO.T℃时,在容积为2L的密闭容器中加入NO和一定量的炭粉在一定条件下发生如下可逆反应:C(s)+2NO(g)?CO2(g)+N2(g),测得各物质的物质的量如下表:
(1)一定温度下,在体积恒定的密闭容器中发生上述反应,下列能判断该反应达到化学平衡状态的是a、d(填字母序号).
a.单位时间内生成2mol NO,同时生成1mol N2
b.NO物质的量与CO2物质的量之比为2:1
c.容器中混合气体的压强不变
d.混合气体的密度不变
(2)0~2min内,用NO表示该反应的平均速率υ(NO)=0.1mol?L-1?min-1.
(3)已知升高温度,该可逆反应的化学平衡常数K增大,则该反应是吸热反应(填“吸热”或“放热”).T℃时,该反应的化学平衡常数K=9/16,则2min时正反应速率大于(填“大于”、“等于”或“小于”)逆反应速率.当该反应达到平衡时,NO的平衡转化率为60.0%.
(4)若其他条件不变,改变下列条件后,所得结论正确的是a、b(填字母序号).
a.恒压时,向容器中充入氦气,反应速率减小
b.升高温度,化学平衡正向移动
c.增大NO的浓度,NO的转化率增大
d.缩小容器的体积,平衡常数增大.
| 活性炭(mol) | NO(mol) | CO2(mol) | N2(mol) | |
| 起始状态 | 3.0 | 0.8 | 0 | 0 |
| 2min时 | 2.8 | 0.4 | 0.2 | 0.2 |
a.单位时间内生成2mol NO,同时生成1mol N2
b.NO物质的量与CO2物质的量之比为2:1
c.容器中混合气体的压强不变
d.混合气体的密度不变
(2)0~2min内,用NO表示该反应的平均速率υ(NO)=0.1mol?L-1?min-1.
(3)已知升高温度,该可逆反应的化学平衡常数K增大,则该反应是吸热反应(填“吸热”或“放热”).T℃时,该反应的化学平衡常数K=9/16,则2min时正反应速率大于(填“大于”、“等于”或“小于”)逆反应速率.当该反应达到平衡时,NO的平衡转化率为60.0%.
(4)若其他条件不变,改变下列条件后,所得结论正确的是a、b(填字母序号).
a.恒压时,向容器中充入氦气,反应速率减小
b.升高温度,化学平衡正向移动
c.增大NO的浓度,NO的转化率增大
d.缩小容器的体积,平衡常数增大.
9.可用于鉴别以下三种化合物的试剂组合是( )
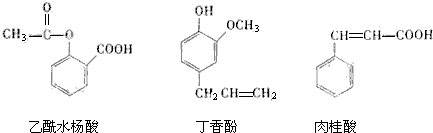
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④碳酸钠溶液.

①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④碳酸钠溶液.
| A. | ②与① | B. | ③与④ | C. | ①与④ | D. | ②与④ |
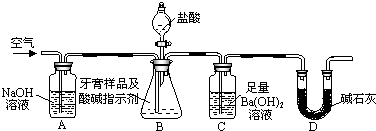
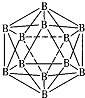 硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题:
硼(B)、铝(Al)、镓(Ga)均属于硼族元素(第ⅢA族),它们的化合物或单质都有重要用途.回答下列问题: ;
;