题目内容
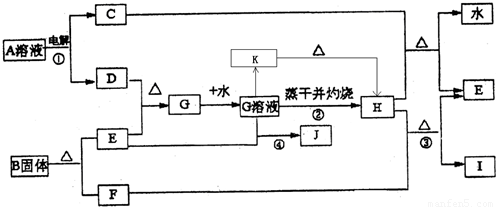
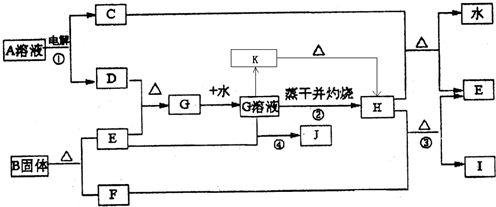
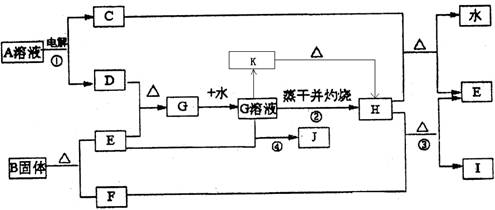
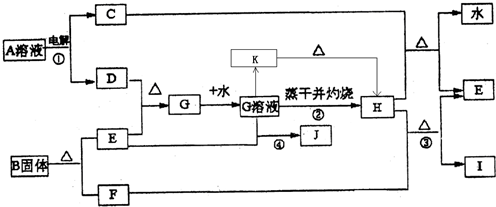
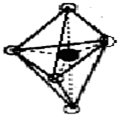
已知:E为常见金属,C、D、F、I均为常见气体,其中C、D为单质,F、I为化合物,且组成元素相同,D、F有毒,I为直线型非极性分子,B的结构为三角双锥(如图所示),图中○代表F分子,●代表E原子,它们有如下框图关系: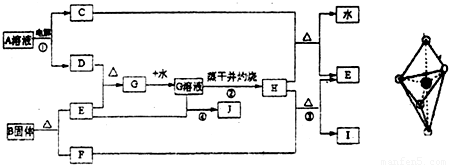
(1)H的颜色是______;B的化学式是______;I的电子式是______.
(2)反应①阳极的电极反应式______.
(3)反应③的化学方程式是______ 2Fe+3CO2
【答案】分析:由电解生成D并且有毒,则D应为氯气,I为直线型非极性分子,则应为CO2,F为CO,根据E与氯气反应后能继续与E反应,说明E是一种变价金属,应为Fe,则G为FeCl3,H为Fe2O3,J为FeCl2,C为H2,B分解生成Fe和CO,根据其结构模型可推知为Fe(CO)5;根据物质的性质结合质量守恒定律书写化学方程式和离子方程式;根据物质的性质完成实验操作.
解答:解:(1)由电解生成D并且有毒,则D应为氯气,I为直线型非极性分子,则应为CO2,其电子式为 ,F为CO,根据E与氯气反应后能继续与E反应,说明E是一种变价金属,应为Fe,则G为FeCl3,H为Fe2O3,为红棕色固体,J为
,F为CO,根据E与氯气反应后能继续与E反应,说明E是一种变价金属,应为Fe,则G为FeCl3,H为Fe2O3,为红棕色固体,J为
FeCl2,C为H2,B分解生成Fe和CO,根据其结构模型可推知为Fe(CO)5;
故答案为:红棕色;Fe(CO)6; ;
;
(2)根据题意,电解A溶液生成氢气和氯气,电解时阳极发生氧化反应,Cl-放电生成Cl2,故答案为:2Cl--2e-═2Cl2↑;
(3)工业炼铁是用还原性气体和CO在高温条件下发生氧化还原反应生成Fe,根据质量守恒定律可写出化学方程式,故答案为:Fe2O3+3CO 2Fe+3CO2;工业炼铁;
2Fe+3CO2;工业炼铁;
(4)反应④为Fe3+和Fe发生氧化还原反应生成e2+,故答案为:2Fe3++Fe═3Fe2+;
(5)氯化铁在加热下易发生水解生成Fe(OH)3,为防止FeCl3水解,应在酸性条件下进行加热浓缩,并进行结晶和过滤,最后才能得到氯化铁晶体,故答案为:在加入盐酸后的溶液中蒸发浓缩、冷却结晶、过滤干燥.;
(6)加热条件下,氯化铁水解生成Fe(OH)3,Fe(OH)3不稳定,在灼烧时发生分解生成Fe2O3,故答案为:因为加热时发生FeCl3+3H2O═Fe(OH)3↓+3HCl↑,这是个完全水解过程,加热蒸干后生成了Fe(OH)3,灼烧时发生了2Fe(OH)3 Fe2O3+3H2O↑,所以把氯化铁溶液蒸干灼烧,最后的得到的固体产物是氧化铁.
Fe2O3+3H2O↑,所以把氯化铁溶液蒸干灼烧,最后的得到的固体产物是氧化铁.
点评:本题考查无机物的推断,并考查盐的水解、物质的制备等知识,具有一定的思维力度,做题时注意找出题目的关键点,牢固掌握物质的性质和实验基础知识.
解答:解:(1)由电解生成D并且有毒,则D应为氯气,I为直线型非极性分子,则应为CO2,其电子式为
 ,F为CO,根据E与氯气反应后能继续与E反应,说明E是一种变价金属,应为Fe,则G为FeCl3,H为Fe2O3,为红棕色固体,J为
,F为CO,根据E与氯气反应后能继续与E反应,说明E是一种变价金属,应为Fe,则G为FeCl3,H为Fe2O3,为红棕色固体,J为FeCl2,C为H2,B分解生成Fe和CO,根据其结构模型可推知为Fe(CO)5;
故答案为:红棕色;Fe(CO)6;
 ;
;(2)根据题意,电解A溶液生成氢气和氯气,电解时阳极发生氧化反应,Cl-放电生成Cl2,故答案为:2Cl--2e-═2Cl2↑;
(3)工业炼铁是用还原性气体和CO在高温条件下发生氧化还原反应生成Fe,根据质量守恒定律可写出化学方程式,故答案为:Fe2O3+3CO
 2Fe+3CO2;工业炼铁;
2Fe+3CO2;工业炼铁;(4)反应④为Fe3+和Fe发生氧化还原反应生成e2+,故答案为:2Fe3++Fe═3Fe2+;
(5)氯化铁在加热下易发生水解生成Fe(OH)3,为防止FeCl3水解,应在酸性条件下进行加热浓缩,并进行结晶和过滤,最后才能得到氯化铁晶体,故答案为:在加入盐酸后的溶液中蒸发浓缩、冷却结晶、过滤干燥.;
(6)加热条件下,氯化铁水解生成Fe(OH)3,Fe(OH)3不稳定,在灼烧时发生分解生成Fe2O3,故答案为:因为加热时发生FeCl3+3H2O═Fe(OH)3↓+3HCl↑,这是个完全水解过程,加热蒸干后生成了Fe(OH)3,灼烧时发生了2Fe(OH)3
 Fe2O3+3H2O↑,所以把氯化铁溶液蒸干灼烧,最后的得到的固体产物是氧化铁.
Fe2O3+3H2O↑,所以把氯化铁溶液蒸干灼烧,最后的得到的固体产物是氧化铁.点评:本题考查无机物的推断,并考查盐的水解、物质的制备等知识,具有一定的思维力度,做题时注意找出题目的关键点,牢固掌握物质的性质和实验基础知识.

练习册系列答案
相关题目
 到
到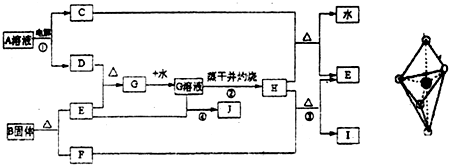

 到
到