题目内容
一定温度下,将a mol PCl5通入一个容积固定不变的密闭容器中,发生反应:PCl5(g)?PCl3(g)+Cl2(g)反应达到平衡时,测得混合气体的压强为p1,此时再向容器中通入a mol PCl5,同样温度下再达到平衡时,测得压强为p2,下列判断正确的是( )
分析:容积固定,达平衡后再向容器中充入amol PCl5,相当于增大了压强;
A、容器容积不变,加入了五氯化磷,压强增大,平衡逆移,所以平衡时总物质的量小于原来的2倍,则平衡时压强小于原来的2倍;
B、由于增大了压强,平衡逆移;
C、达平衡后再向容器中充入amol PCl5,相当于增大了压强;
D、由于增大了压强,平衡逆移,Cl2的体积分数减小.
A、容器容积不变,加入了五氯化磷,压强增大,平衡逆移,所以平衡时总物质的量小于原来的2倍,则平衡时压强小于原来的2倍;
B、由于增大了压强,平衡逆移;
C、达平衡后再向容器中充入amol PCl5,相当于增大了压强;
D、由于增大了压强,平衡逆移,Cl2的体积分数减小.
解答:解:容积固定,达平衡后再向容器中充入amol PCl5,相当于增大了压强;
A、容器容积不变,加入了五氯化磷,压强增大,平衡逆移,所以平衡时总物质的量小于原来的2倍,则平衡时压强小于原来的2倍,所以2P1>P2,故A正确;
B、由于增大了压强,平衡逆移,所以PCl5的分解率减小,故B错误;
C、达平衡后再向容器中充入amol PCl5,相当于增大了压强,所以p1<p2;故C错误;
D、由于增大了压强,平衡逆移,生成的氯气的量减少,Cl2的体积分数减小,故D正确;
故选:AD.
A、容器容积不变,加入了五氯化磷,压强增大,平衡逆移,所以平衡时总物质的量小于原来的2倍,则平衡时压强小于原来的2倍,所以2P1>P2,故A正确;
B、由于增大了压强,平衡逆移,所以PCl5的分解率减小,故B错误;
C、达平衡后再向容器中充入amol PCl5,相当于增大了压强,所以p1<p2;故C错误;
D、由于增大了压强,平衡逆移,生成的氯气的量减少,Cl2的体积分数减小,故D正确;
故选:AD.
点评:本题考查压强对化学平衡的影响,注意容器容积不变,气体物质的量增大压强增大,本题难度中等.

练习册系列答案
相关题目
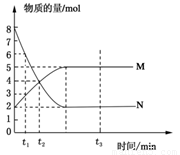
 在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )
在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是( )| A、t2时M与N的物质的量浓度之比为1:1 | ||
| B、t2与t3时刻的混合气体的平均相对分子质量相等 | ||
| C、反应物与生成物平衡时的物质的量浓度之比是2:5 | ||
D、0~t2内用M表示的平均反应速率是
|

 HCO3-+OH-
HCO3-+OH- (2012?通州区一模)一定温度下,将1mol X和1mol Y气体充入2L恒容密闭容器,发生反应X(g)+Y(g)?mZ(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )
(2012?通州区一模)一定温度下,将1mol X和1mol Y气体充入2L恒容密闭容器,发生反应X(g)+Y(g)?mZ(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )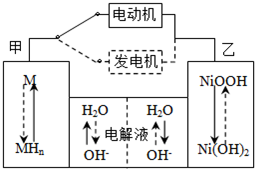
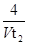 mol/(L•min)
mol/(L•min)