��Ŀ����
����������SuSO4����һ����Ҫ�������Σ��㷺Ӧ���ڶ�����ҵ��ij�о�С�����SnSO4�Ʊ�·�����£�
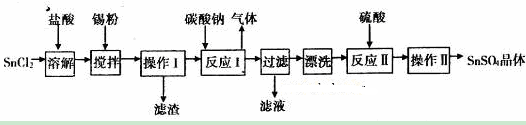
�������ϣ�
I�����������£�����ˮ��Һ����Sn2+��Sn4+������Ҫ������ʽ��Sn2+�ױ�������
II��SnC12��ˮ�����ɼ�ʽ�Ȼ�����[Sn(OH)Cl]��
�ش��������⣺
��1��SnC12��ĩ��Ҫ��Ũ��������ܽ⣬���û�ѧ����ʽ˵��ԭ��___________________��
��2����SnC12��Һ�м���Sn�۵��������������ٵ�����ҺpH ��_________________��
��3������I��ʹ�õIJ���������___________________��
��4����С��ͨ�����з����ⶨ�������۵Ĵ��ȣ����ʲ����뷴Ӧ����
�ٽ��������������У������ķ�ӦΪ��Sn+2HCl�TSnCl2+H2����
�ڼ��������FeCl3�������ķ�ӦΪ��SnCl2+ FeCl3= SnCl4+ FeCl2
������֪Ũ�ȵ�K2Cr2O7�ζ����ɵ�Fe2+�������ķ�ӦΪ��6FeCl2+K2Cr2O7+14HCl�T6FeCl3+2KCl+2CrCl3+7H2O
�ζ�ʱ��K2Cr2O7��ҺӦ��װ��____________�����ʽ����ʽ�����ζ����С�
��ȡ2��0g���ۣ�������������Ӧ����ȥ0��100mol/L K2Cr2O7��Һ40��00mL����������������������____________________��
��1��SnCl2+H2O Sn(OH)Cl+HCl��2����ֹSn2+��������3��©�������������ձ���4����ʽ��71��4%
Sn(OH)Cl+HCl��2����ֹSn2+��������3��©�������������ձ���4����ʽ��71��4%
��������
�����������1��SnCl2��ˮ�����ɼ�ʽ�Ȼ�����������ƽ��SnCl2+H2O Sn(OH)Cl+HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ�⣻��2��������֪Sn2+�ױ�����������Sn�۳�������ҺpH�⣬����ֹSn2+����������3��������ͼ��֪���������Ǵ���Һ�еõ����ᾧˮ�ľ��壬ֻ�ܲ�ȡ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӵõ������õ��IJ�������Ϊ©�������������ձ�����4����ʽ�ζ��ܵĽ������ظ������Һ����һ����������������Ӱ��Ũ�ȣ���������������������Ϊx����
Sn(OH)Cl+HCl���������ᣬʹ��ƽ�������ƶ�������Sn2+ˮ�⣻��2��������֪Sn2+�ױ�����������Sn�۳�������ҺpH�⣬����ֹSn2+����������3��������ͼ��֪���������Ǵ���Һ�еõ����ᾧˮ�ľ��壬ֻ�ܲ�ȡ����Ũ������ȴ�ᾧ�����ˡ�ϴ�ӵõ������õ��IJ�������Ϊ©�������������ձ�����4����ʽ�ζ��ܵĽ������ظ������Һ����һ����������������Ӱ��Ũ�ȣ���������������������Ϊx����
Sn��Sn2+��2Fe3+��2Fe2+��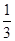 K2Cr2O7���㣮
K2Cr2O7���㣮
119g
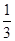 mol
mol
2��0g��x 0��100mol/L��0��040L
��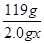 =
=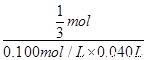
���x=71��4%��
���㣺��ѧ����ʽ���йؼ��㣻���ʷ�����ᴿ�ķ����ͻ��������ۺ�Ӧ�ã��Ʊ�ʵ�鷽�������

 ��У����ϵ�д�
��У����ϵ�д�