题目内容
【题目】一定体积的CH4在密闭容器中与一定量的氧气燃烧后得到的产物为CO、CO2和水蒸气,此混合气重4.96g,当其缓慢经过浓硫酸时,浓硫酸增重2.52g.原混合气体中CO2的质量为( )
A. 1.25g B. 1.32g C. 1.97g D. 2.44g
【答案】B
【解析】混合气重4.96g,当其缓慢经过浓硫酸时,浓硫酸增重2.52g,增重为生成物中水的质量,n(H2O)=2.52g÷18g/mol=0.14mol,由H原子守恒可得n(CH4)=0.7mol,再由C原子守恒可得n(CO)+n(CO2)= 0.7mol,由m(CO)+m(CO2)=n(CO) ![]() 28g/mol+n(CO2)
28g/mol+n(CO2) ![]() 44g/mol=4.96g-2.52g,联立两等式解方程,可得n(CO2)=0.03mol,质量为0.03mol×44g/mol=1.32g,答案选B。
44g/mol=4.96g-2.52g,联立两等式解方程,可得n(CO2)=0.03mol,质量为0.03mol×44g/mol=1.32g,答案选B。

练习册系列答案
相关题目
【题目】请按要求回答下列问题:
(1)某同学设计下图装置进行探究“铜和稀硝酸反应制取NO”的实验(夹持装置已略去),则制取NO的化学方程式为:____________;
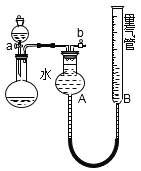
利用该装置还可制取并收集少量其他气体,请完成下表:
制取气体 | 药品 |
O2 | __________ |
_______ | 某溶液_________________、Al |
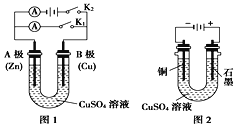
(2)根据图1回答:
①打开K1,合上K2。则此时此装置为 ______;A电极可观察到的现象是____。
(3)根据图2回答:
将纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为_________________。
图2对应的实验完成后,铜电极增重6.4g,石墨电极产生标准状况下的气体体积_____L。