��Ŀ����
��������Ҫ�Ļ�����Ʒ֮һ��
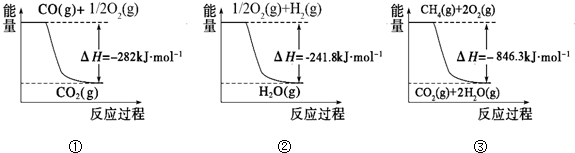
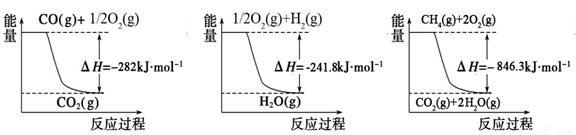
��1���ϳɰ��õ��������Լ���Ϊԭ�ϲ��Ƶã��йػ�ѧ��Ӧ�������仯����ͼ��ʾ����CH4��g����H2O��g����Ӧ����CO��g����H2��g�����Ȼ�ѧ����ʽΪ______��

��2���������˽���ų�ֱ�Ӽ��ڵ�����������Ӧ�������ڣ��ڽϵ͵��¶Ⱥ�ѹǿ�����ºϳɰ�������˽ϺõIJ��ʣ��ӻ�ѧ��Ӧ���ʽǶȷ�������ų��Ժϳɰ���Ӧ��������______���봫ͳ�ĺϳɰ��ķ����Ƚϣ��÷������ŵ���______��
��3��ֱ�ӹ���ʽ����ȼ�ϵ�صĵ�ط�ӦΪ��4NH3+3O2�T2N2+6H2O�������缫��ӦʽΪ��______��
��4��������ȡ����[CO��NH2��2]�ĺϳ����з�����Ӧ��2NH3��g��+CO2��g��?CO��NH2��2��l��+H2O��g����ͼ4Ϊ�ϳ����в�ͬ��̼��a[n��NH3��/n��CO2��]��ˮ̼��b[n��H2O��/n��CO2��]ʱ������̼ת���ʣ�x����b�˿�����______������ţ���Χ�ڣ�A��0.6��0.7����B��1��1.1��C��1.5��1.61����a�˿�����4.0���ң�������______��
��5���������������Ṥҵ�У�����������Һ��ȥβ���е������NO��NO2����β���е�NO��NO2��ˮ��Ӧ���������ᣬ�������������ط�Ӧ���ɶԴ�������Ⱦ�����壮1mol���������չ�ҵβ���е����������NO��NO2�����Ϊ1��1��������Ϊ______g��
 O2��g���TCO2��g����H=-282kJ?mol-1 ��H2��g��+
O2��g���TCO2��g����H=-282kJ?mol-1 ��H2��g��+ O2��g���TH2O��g����H=-241.8kJ?mol-1
O2��g���TH2O��g����H=-241.8kJ?mol-1��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H=-846.3kJ?mol-1��
�ɢ�-����+�ڡ�3���ã�CH4��g��+H2O��g���TCO��g��+3H2��g����H=+161.1kJ?mol-1���ʴ�Ϊ��CH4��g��+H2O��g���TCO��g��+3H2��g����H=+161.1kJ?mol-1��
��2���ڵ�ų��������µ��������������ѣ������˷�Ӧ����Ҫ����������Ӧ�������У���ͳ�ĺϳɰ��������Ǹ��¡���ѹ���÷������ŵ��ǵ��¡���ѹ�������ͽ�Լ����Դ�������˶��豸��Ҫ��
�ʴ�Ϊ���ڵ�ų��������µ��������������ѣ������˷�Ӧ����Ҫ����������Ӧ�������У���Լ����Դ�������˶��豸��Ҫ��3����������������Ӧ�����������������������缫��ӦʽΪ2NH3-6e-+6OH-=N2+6H2O���ʴ�Ϊ��2NH3-6e-+6OH-=N2+6H2O��
��4����̼��a[n��NH3��/n��CO2��]��ͬʱ��ˮ̼��b[n��H2O��/n��CO2��]Ϊ0.6��0.7ʱ��������̼ת������ʴ�Ϊ��A��
��̼��a[n��NH3��/n��CO2��]����4.0ʱ�������������ʵ�����������̼��ת�������Ӳ��������������ɱ�����̼��a[n��NH3��/n��CO2��]С��4.0ʱ��������̼��ת���ʽ�С��
�ʴ�Ϊ����̼��a[n��NH3��/n��CO2��]����4.0ʱ�������������ʵ�����������̼��ת�������Ӳ��������������ɱ�����̼��a[n��NH3��/n��CO2��]С��4.0ʱ��������̼��ת���ʽ�С��
��5������Ŀ��Ϣ��֪��NO��NO2���������ˮ��Ӧ���������ᣬ��Ӧ����ʽΪNO+NO2+H2O=2HNO2���������������ط�Ӧ����CO2��N2����Ӧ����ʽΪCO ��NH2��2+2HNO2=CO2+2N2+3H2O��
NO+NO2 ��2HNO2 ��CO��NH2��2
��30+46��g 1mol
1mol���������չ�ҵβ���е����������NO��NO2�����Ϊ1��1��������Ϊ76g���ʴ�Ϊ��76��
��������1���ֱ����ͼ1��ͼ2��ͼ3д���Ȼ�ѧ����ʽ��Ȼ����ݸ�˹���������
��2�����ݻ�ѧ��Ӧ�ı����Ǿɼ��Ķ��Ѻ��¼����γɣ����¶Ⱥ�ѹǿ�ĽǶȿ��ǣ�
��3����������������Ӧ����������������������
��4�����ݰ�̼��a[n��NH3��/n��CO2��]��ͬʱ��ˮ̼��b[n��H2O��/n��CO2��]Ϊ0.6��0.7ʱ��������̼ת�������
���ݰ�̼��a[n��NH3��/n��CO2��]����4.0ʱ�������������ʵ�����������̼��ת�������Ӳ��������������ɱ�����̼��a[n��NH3��/n��CO2��]С��4.0ʱ��������̼��ת���ʽ�С��
��5��������Ŀ��Ϣд������ʽ��������ϵʽ��Ȼ�����ݹ�ϵʽ���м��㣻
������������Ҫ�����˵缫��Ӧ����ѧƽ���ƶ�����ѧ����ȣ��ѶȲ���������ѧ�����������������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д���������Ҫ�Ļ�����Ʒ֮һ��
��1���ϳɰ��õ��������Լ���Ϊԭ���Ƶ�:CH4(g)+H2O(g�� CO(g)+3H2(g)���йػ�ѧ��Ӧ�������仯����ͼ��ʾ��CH4(g)��H2O(g)��Ӧ����CO(g)��H2(g)���Ȼ�ѧ����ʽΪ
��
CO(g)+3H2(g)���йػ�ѧ��Ӧ�������仯����ͼ��ʾ��CH4(g)��H2O(g)��Ӧ����CO(g)��H2(g)���Ȼ�ѧ����ʽΪ
��



��2��CO�Ժϳɰ��Ĵ����ж������ã��������������ͭ(��)��Һ������ԭ������CO���䷴Ӧԭ��Ϊ��[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO��CO(l�� ��H��0������CO�������ͭ��Һ�����ʵ��������ֿ��������ָ�������CO�������Թ�ѭ��ʹ�ã����������������� __________����дѡ���ţ���
[Cu(NH3)3]CH3COO��CO(l�� ��H��0������CO�������ͭ��Һ�����ʵ��������ֿ��������ָ�������CO�������Թ�ѭ��ʹ�ã����������������� __________����дѡ���ţ���
A�����¡���ѹ B�����¡���ѹ C�����¡���ѹ D�����¡���ѹ
��3���ð�����ȡ����[CO(NH2)2]�ķ�ӦΪ��2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g�� ��H��0��ij�¶��£����ݻ�Ϊ100L���ܱ�������ͨ��4mol
NH3��2molCO2���÷�Ӧ���е�40 sʱ�ﵽƽ�⣬��ʱCO2��ת����Ϊ50%�����¶��´˷�Ӧƽ�ⳣ��K��ֵΪ________����ͼ�е����߱�ʾ�÷�Ӧ��ǰ25 s�ڵķ�Ӧ�����е�NH3Ũ�ȱ仯������Ӧ������70s����������������������£�����ͼ����ʵ����ʹ�ô���ʱ�÷�Ӧ�Ľ������ߡ�
CO(NH2)2(l)+H2O(g�� ��H��0��ij�¶��£����ݻ�Ϊ100L���ܱ�������ͨ��4mol
NH3��2molCO2���÷�Ӧ���е�40 sʱ�ﵽƽ�⣬��ʱCO2��ת����Ϊ50%�����¶��´˷�Ӧƽ�ⳣ��K��ֵΪ________����ͼ�е����߱�ʾ�÷�Ӧ��ǰ25 s�ڵķ�Ӧ�����е�NH3Ũ�ȱ仯������Ӧ������70s����������������������£�����ͼ����ʵ����ʹ�ô���ʱ�÷�Ӧ�Ľ������ߡ�

��4��������ʩ����������ͨ��ת��Ϊ̼��炙�̼����狀�ű����������ã����ط�����������ڵ���ø�����£�ת��Ϊ̼��李���֪���������ˮ�еĵ���ƽ�ⳣ����25�棩���±���
|
������� |
H2CO3 |
NH3��H2O |
|
����ƽ�ⳣ�� |
Ka1=4.30��10-7 Ka2=5.61��10-11 |
1.77��10-5 |
���г�����0.1 mol��L-1��(NH4)2CO3��Һ��
������Ϊ����Һ�� �ԣ���ᡱ�����С����������ԭ���� ��
�ھ���Һ������֮�������й�ϵʽ������Ϊ������ȷ���� ��
A��c(NH4+)��c(CO32-)��c(HCO3-)��c(NH3��H2O)
B��c(NH4+)+c(H+)��c(HCO3-)+c(OH-)+c(CO32-)
C��c(CO32-��+ c(HCO3-��+c(H2CO3)��0.1 mol��L-1
D��c(NH4+)+ c(NH3��H2O)��2c(CO32-��+ 2c(HCO3-��+2c(H2CO3)

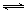 CO(NH2)2(l)+H2O(g)��
CO(NH2)2(l)+H2O(g)��