题目内容
氨是最重要的化工产品之一。
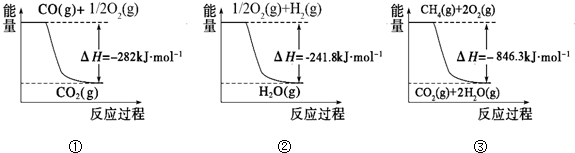
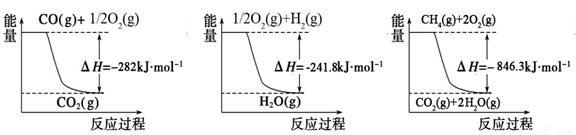
(1)合成氨用的氢气可以甲烷为原料制得:CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
。
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
。



(2)CO对合成氨的催化剂有毒害作用,常用乙酸二氨合铜(Ⅰ)溶液来吸收原料气中CO,其反应原理为:[Cu(NH3)2CH3COO](l)+CO(g)+NH3(g) [Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 __________(填写选项编号)。
[Cu(NH3)3]CH3COO·CO(l) △H<0。吸收CO后的乙酸铜氨液经过适当处理后又可再生,恢复其吸收CO的能力以供循环使用,再生的适宜条件是 __________(填写选项编号)。
A.高温、高压 B.高温、低压 C.低温、低压 D.低温、高压
(3)用氨气制取尿素[CO(NH2)2]的反应为:2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g) △H<0。某温度下,向容积为100L的密闭容器中通入4mol
NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。
CO(NH2)2(l)+H2O(g) △H<0。某温度下,向容积为100L的密闭容器中通入4mol
NH3和2molCO2,该反应进行到40 s时达到平衡,此时CO2的转化率为50%。该温度下此反应平衡常数K的值为________。下图中的曲线表示该反应在前25 s内的反应进程中的NH3浓度变化。若反应延续至70s,保持其它条件不变情况下,请在图中用实线画出使用催化剂时该反应的进程曲线。

(4)将尿素施入土壤后,大部分是通过转化为碳酸铵或碳酸氢铵后才被作物所利用,尿素分子在微生物分泌的脲酶作用下,转化为碳酸铵。已知弱电解质在水中的电离平衡常数(25℃)如下表:
|
弱电解质 |
H2CO3 |
NH3·H2O |
|
电离平衡常数 |
Ka1=4.30×10-7 Ka2=5.61×10-11 |
1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①你认为该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②就该溶液中粒子之间有下列关系式,你认为其中正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3·H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+ c(HCO3-)+c(H2CO3)=0.1 mol·L-1
D.c(NH4+)+ c(NH3·H2O)=2c(CO32-)+ 2c(HCO3-)+2c(H2CO3)
(1)CH4(g)+H2O(g) CO(g)+3H2(g)△H=+161.1 kJ·mol-1(2分)(2)B(2分)
CO(g)+3H2(g)△H=+161.1 kJ·mol-1(2分)(2)B(2分)
(3)2500(2分);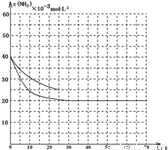 (说明:曲线的转折点在横坐标40之前,纵坐标必需在20的线上)(3分,画出纵坐标为20的直线给2分、画出曲线转折点在横坐标40之前给1分)
(说明:曲线的转折点在横坐标40之前,纵坐标必需在20的线上)(3分,画出纵坐标为20的直线给2分、画出曲线转折点在横坐标40之前给1分)
(4)① 碱 (1分);由于NH3·H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,溶液中c(OH-)>c(H+),溶液呈碱性(2分) ② A、C、D(3分)
【解析】
试题分析:(1)根据图像可知热化学方程式,①、CH4(g)+2O2(g) 2H2O(g)+CO2(g) △H=-846.3kJ/mol,②、CO(g)+
2H2O(g)+CO2(g) △H=-846.3kJ/mol,②、CO(g)+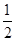 O2(g)
O2(g)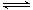 CO2(g)△H=+282kJ/mol,③、H2(g)+
CO2(g)△H=+282kJ/mol,③、H2(g)+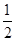 O2(g)
O2(g)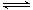 H2O(g)△H=-241.8kJ/mol,则根据盖斯定律可知①-②-③×3即得到热化学方程式CH4(g)+H2O(g)
H2O(g)△H=-241.8kJ/mol,则根据盖斯定律可知①-②-③×3即得到热化学方程式CH4(g)+H2O(g)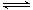 CO(g)+3H2(g),所以该反应的反应热△H=-846.3kJ/mol+282kJ/mol+241.8kJ/mol×3=+161.1 kJ/mol。
CO(g)+3H2(g),所以该反应的反应热△H=-846.3kJ/mol+282kJ/mol+241.8kJ/mol×3=+161.1 kJ/mol。
(2)根据方程式可知该反应是体积减小的、放热的可逆反应,所以要恢复其吸收CO的能力以供循环使用,应该使平衡向逆反应方向移动,所以再生的适宜条件是高温、低压,答案选B。
(3)
2NH3(g)+CO2(g) CO(NH2)2(l)+H2O(g)
CO(NH2)2(l)+H2O(g)
起始浓度(mol/L) 0.04 0.02 0 0
转化浓度(mol/L) 0.02 0.01 0.01 0.01
平衡浓度(mol/L)0.02 0.01 0.01 0.01
所以该温度下平衡常数K=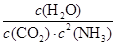 =
=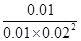 =2500。
=2500。
由于催化剂能加快反应速率,缩短到达平衡的时间,但不能改变平衡状态,据此可以作图。
(4)①根据表中数据可知,NH3·H2O的电离平衡常数大于HCO3-的电离平衡常数,因此CO32-水解程度大于NH4+水解程度,因此溶液中c(OH-)>c(H+),所以溶液呈碱性。
②A、由于CO32-水解程度大于NH4+水解程度,溶液显碱性,则水解程度都是很小的,所以c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3·H2O),A正确;B、根据电荷守恒可知c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),B不正确;C、根据物料守恒可知c(CO32-)+ c(HCO3-)+c(H2CO3)=0.1 mol·L-1,C正确;D、碳氧根据物料守恒可知c(NH4+)+ c(NH3·H2O)=2c(CO32-)+ 2c(HCO3-)+2c(H2CO3),D正确,答案选ACD。
考点:考查热化学方程式的书写、平衡常数计算、外界条件对平衡状态的影响、溶液酸碱性判断以及溶液中离子浓度大小比较

 口算能手系列答案
口算能手系列答案
 CO(NH2)2(l)+H2O(g)。
CO(NH2)2(l)+H2O(g)。