题目内容
(2009?龙岩一模)工业合成氨与制备硝酸一般可连续生产,流程如图1:
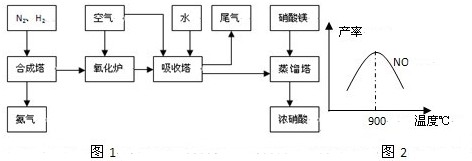
(1)工业生产时,制取氢气的一个反应为:CO+H2O?CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.该温度下此反应的平衡常数K=
②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)=
(2)合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g);△H<0.右表为不同温度下该反应的平衡常数.由此可推知,表中T1
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3+5O2?4NO+6H2O△H=-905kJ?mol-1
不同温度下NO产率如图2所示.温度高于900℃时,NO产率下降的原因
(4)吸收塔中反应为:3NO2+H2O?2HNO3+NO.从生产流程看,吸收塔中需要补充空气,其原因是
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:

(1)工业生产时,制取氢气的一个反应为:CO+H2O?CO2+H2
①t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol?L-1.该温度下此反应的平衡常数K=
1
1
.②保持温度不变,向上述平衡体系中再加入0.1molCO,当反应重新建立平衡时,水蒸气的总转化率α (H2O)=
50%
50%
.(2)合成塔中发生反应为:N2(g)+3H2(g)?2NH3(g);△H<0.右表为不同温度下该反应的平衡常数.由此可推知,表中T1
<
<
573K(填“>”、“<”或“=”).| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
4NH3+5O2?4NO+6H2O△H=-905kJ?mol-1
不同温度下NO产率如图2所示.温度高于900℃时,NO产率下降的原因
温度高于900℃时,平衡向左移动
温度高于900℃时,平衡向左移动
.(4)吸收塔中反应为:3NO2+H2O?2HNO3+NO.从生产流程看,吸收塔中需要补充空气,其原因是
充入空气,NO转化为NO2,有利于提高原料利用率
充入空气,NO转化为NO2,有利于提高原料利用率
.(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气.目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol
CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ/mol
.分析:(1)根据平衡常数表达式以及各种物质的浓度知识来回答;
(2)温度和平衡常数间的关系取决于平衡受温度的影响情况;
(3)对于放热反应,温度升高,则化学平衡向逆向移动;
(4)从浓度对平衡移动的影响分析;
(5)根据盖斯定律来计算反应的焓变,进而书写热化学方程式.
(2)温度和平衡常数间的关系取决于平衡受温度的影响情况;
(3)对于放热反应,温度升高,则化学平衡向逆向移动;
(4)从浓度对平衡移动的影响分析;
(5)根据盖斯定律来计算反应的焓变,进而书写热化学方程式.
解答:解:(1)①CO+H2O(g)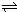 CO2 +H2
CO2 +H2
初始:0.2 0.3 0 0
变化:0.12 0.12 0.12 0.12
平衡:0.08 0.18 0.12 0.12
则K=
=1,
故答案为:1;
②保持温度不变,向上述平衡体系中再加入0.1molCO,相当于充入0.3molCO和0.3mol水蒸气,设H2O的转化了xmol
CO+H2O(g)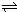 CO2 +H2
CO2 +H2
起始:0.3 0.3 0 0
转化:x x x x
平衡0.3-x 0.3-x x x
则
=1,
x=0.15,
水蒸气的总转化率α (H2O)=
×100%=50%,
故答案为:50%;
(2)对于放热反应,温度越高,则化学平衡逆向移动,导致平衡常数减小,所以T1<573K,故答案为:<;
(3)对于放热反应,温度升高,则化学平衡向逆向移动,所以氨气的产率减小,
故答案为:温度高于900℃时,平衡向左移动;
(4)补充空气,氧气的浓度增大,NO转化为NO2,则平衡向正反应方向移动,有利于提高原料利用率,
故答案为:充入空气,NO转化为NO2,有利于提高原料利用率;
(5)根据题意:①
CH4(g)+2NO2(g)=2NO(g)+
CO2(g)+H2O(g)△H=
×(-574kJ?mol-1)=-287kJ?mol-1;
CH4(g)+2NO(g)=N2(g)+
CO2(g)+H2O(g)△H=
×(-1160kJ?mol-1)=-580kJ?mol-1;
根据盖斯定律反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)可以看成是①+②,
所以△H=-287kJ?mol-1-580kJ?mol-1=-867kJ?mol-1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1.
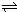 CO2 +H2
CO2 +H2初始:0.2 0.3 0 0
变化:0.12 0.12 0.12 0.12
平衡:0.08 0.18 0.12 0.12
则K=
| 0.12×0.12 |
| 0.08×0.18 |
故答案为:1;
②保持温度不变,向上述平衡体系中再加入0.1molCO,相当于充入0.3molCO和0.3mol水蒸气,设H2O的转化了xmol
CO+H2O(g)
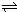 CO2 +H2
CO2 +H2起始:0.3 0.3 0 0
转化:x x x x
平衡0.3-x 0.3-x x x
则
| x2 |
| (0.3-x)2 |
x=0.15,
水蒸气的总转化率α (H2O)=
| 0.15 |
| 0.3 |
故答案为:50%;
(2)对于放热反应,温度越高,则化学平衡逆向移动,导致平衡常数减小,所以T1<573K,故答案为:<;
(3)对于放热反应,温度升高,则化学平衡向逆向移动,所以氨气的产率减小,
故答案为:温度高于900℃时,平衡向左移动;
(4)补充空气,氧气的浓度增大,NO转化为NO2,则平衡向正反应方向移动,有利于提高原料利用率,
故答案为:充入空气,NO转化为NO2,有利于提高原料利用率;
(5)根据题意:①
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
根据盖斯定律反应CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)可以看成是①+②,
所以△H=-287kJ?mol-1-580kJ?mol-1=-867kJ?mol-1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1.
点评:本题是一道工业合成氨的综合性知识题目,题目难度较大,注意利用三段式法解答,特别是盖斯定律的运用.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目