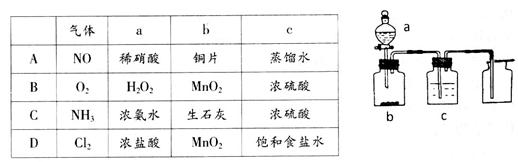
题目内容
将少量CO2通入下列溶液中,无沉淀产生的是
| A.Ba(OH)2溶液 | B.澄清石灰水 | C.氯化钡溶液 | D.漂白粉溶液 |
C
解析试题分析:A.发生反应:Ba(OH)2+ CO2= BaCO3↓+H2O。产生沉淀。错误。B. Ca(OH)2+ CO2= CaCO3↓+H2O。产生沉淀。错误。C.假如发生反应,则方程式为:BaCl2+ CO2+H2O = BaCO3↓+2HCl,但是BaCO3能和HCl发生反应BaCO3+2HCl= BaCl2+ CO2↑+H2O。这证明假设不成立。即氯化钡溶液不能与CO2发生沉淀反应。正确。D.漂白粉是CaCl2和Ca(ClO)2的混合物。由于酸性H2CO3>HClO,所以在溶液中发生反应:Ca(ClO)2+ CO2+H2O = CaCO3↓+2HclO。所以会产生沉淀。错误。
考点:考查CO2发生的沉淀反应的知识。

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
2012年3月中国气象报发布信息,近三年来,我国重酸雨区范围缩小约70%,但仍处于较高水平。你认为减少酸雨产生可采取的措施是
①工厂烟囱造高一些;②将矿石燃料脱硫;③在已酸化的土壤中加石灰;④开发新能源
| A.②③④ | B.①②④ | C.②④ | D.①③ |
实验室中制备HClO溶液的最好方法是将Cl2缓慢通入
| A.蒸馏水 | B.烧碱溶液 | C.纯碱溶液 | D.石灰石的悬浊液 |
对下列事实的解释正确的是( )。
| A.二氧化硫气体能用浓硫酸干燥,是因为二氧化硫无还原性 |
| B.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于酸 |
| C.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol |
| D.常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓H2SO4不反应 |
向5 mL 18 mol/L的硫酸中加入足量铜片并加热使其充分反应,下列说法正确的是( )
| A.有0.09 mol的硫酸被还原 |
| B.有0.045 mol的硫酸被还原 |
| C.充分反应后体系无硫酸剩余 |
| D.消耗的铜的质量一定小于2.88 g |
氯气与二氧化硫都有漂白作用,若将等物质的量的这两种气体混合后通入品红和BaCl2的混合溶液中,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
| A.①② | B.①③ | C.②③ | D.②④ |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子结构,则下列有关说法中,不正确的是 ( )。
| A.1 mol NH5中含有5NA个N—H键(NA表示阿伏加德罗常数) |
| B.NH5中既有共价键又有离子键,它形成的晶体是离子晶体 |
C.NH5的电子式为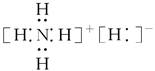 |
| D.它与水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑ |