题目内容
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.
甲同学认为两者反应只生成CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
I.按照乙同学的观点,请写出Na2CO3溶液和CuSO4溶液反应的离子方程式:
Ⅱ.在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是

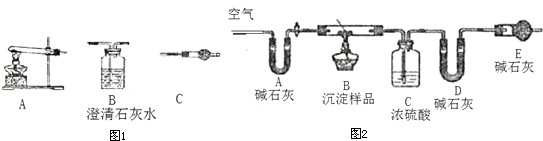
(1)装置B中所装试剂是
(2)能证明乙同学观点正确的实验现象是
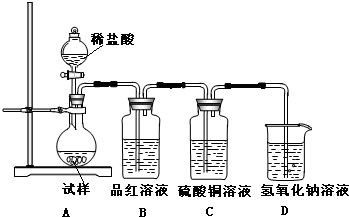
Ⅲ.若CuCO3和Cu(OH)2两种沉淀都有,可通过下列所示装置的连接,进行定量分析来测定其组成.
(3)各装置连接顺序为
(4)装置C中碱石灰的作用是
(5)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为
甲同学认为两者反应只生成CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀.(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
I.按照乙同学的观点,请写出Na2CO3溶液和CuSO4溶液反应的离子方程式:
Cu2++CO32-+H2O=Cu(OH)2 ↓+CO2↑或CO32-+H2O HCO3-+OH-,Cu2++2OH-=Cu(OH)2 ↓
Cu2++CO32-+H2O=Cu(OH)2 ↓+CO2↑或CO32-+H2O HCO3-+OH-,Cu2++2OH-=Cu(OH)2 ↓
.Ⅱ.在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是
取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净
取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净
.并用下图所示装置,选择必要的试剂,定性探究生成物的成分.
(1)装置B中所装试剂是
CuSO4
CuSO4
.(2)能证明乙同学观点正确的实验现象是
B中无水硫酸铜变蓝,C中澄清石灰水不变浑浊
B中无水硫酸铜变蓝,C中澄清石灰水不变浑浊
.Ⅲ.若CuCO3和Cu(OH)2两种沉淀都有,可通过下列所示装置的连接,进行定量分析来测定其组成.

(3)各装置连接顺序为
C
C
接A
A
接B
B
接E
E
接D
D
.(4)装置C中碱石灰的作用是
吸收空气中的H2O 蒸汽和CO2
吸收空气中的H2O 蒸汽和CO2
,实验开始时和实验结束时都要通入过量的空气,其作用分别是开始时通入处理过的空气可以将装置中原有的H2O 蒸汽和CO2排出;结束时通入处理过的空气可以将装置中滞留的H2O 蒸汽和CO2赶出
开始时通入处理过的空气可以将装置中原有的H2O 蒸汽和CO2排出;结束时通入处理过的空气可以将装置中滞留的H2O 蒸汽和CO2赶出
.(5)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为
1-
| 49n |
| 9m |
1-
.| 49n |
| 9m |
分析:Ⅰ.根据Cu2+与CO32-发生相互促进的水解反应生成CO2和Cu(OH)2 书写反应的离子方程式;
Ⅱ.检验沉淀是否洗涤干净,可取最后一次洗涤液加入合适的化学试剂进行检验,根据氢氧化铜加热分解生成水的性质选择检验试剂;
Ⅲ.若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,根据质量的增加值计算碳酸铜和氢氧化铜的质量,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收.
Ⅱ.检验沉淀是否洗涤干净,可取最后一次洗涤液加入合适的化学试剂进行检验,根据氢氧化铜加热分解生成水的性质选择检验试剂;
Ⅲ.若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,根据质量的增加值计算碳酸铜和氢氧化铜的质量,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收.
解答:解:Ⅰ.Cu2+与CO32-发生相互促进的水解反应生成CO2和Cu(OH)2 ,可分别发生:CO32-+H2O?HCO3-+OH-,Cu2++2OH-=Cu(OH)2 ↓,也可写成总反应式:Cu2++CO32-+H2O=Cu(OH)2 ↓+CO2↑,
故答案为:Cu2++CO32-+H2O=Cu(OH)2 ↓+CO2↑或CO32-+H2O?HCO3-+OH-,Cu2++2OH-=Cu(OH)2 ↓;
Ⅱ.沉淀具有吸附能力,可吸附硫酸根离子,通过加入氯化钡的方法进行检验,通常做法是取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净,
故答案为:取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净;
(1)如有Cu(OH)2,解热时生成水,用无水硫酸铜检验,如白色固体变为蓝色,说明有水生成,故答案为:CuSO4;
(2)如为Cu(OH)2,解热时生成水,则B中无水硫酸铜变蓝,并且C中澄清石灰水不变浑浊,故答案为:B中无水硫酸铜变蓝,C中澄清石灰水不变浑浊;
Ⅲ.(3)若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收,则实验仪器的连接顺序应为C A B E D(或C A B D E),
故答案为:C A B E D(或C A B D E);
(4)为保证样品加热分解生成的二氧化碳和水蒸气完全被吸收,应通入空气,由于空气中含有二氧化碳和水蒸气,应先通过盛有碱石灰的装置B,反应结束后,为防止空气的中二氧化碳和水蒸气被吸收,应在装置的后面连接盛有碱石灰的干燥管,
故答案为:吸收空气中的H2O 蒸汽和CO2;开始时通入处理过的空气可以将装置中原有的H2O 蒸汽和CO2排出;结束时通入处理过的空气可以将装置中滞留的H2O 蒸汽和CO2赶出.
(5)若沉淀样品的质量为m克,装置B质量增加了n克,应为水的质量,发生:Cu(OH)2
CuO+H2O,
Cu(OH)2
CuO+H2O
98g 18g
m(Cu(OH)2) ng
m(Cu(OH)2)=
g,
m(CuCO3)=mg-
g,
ω(CuCO3)=
=1-
,
则沉淀中CuCO3的质量分数为1-
,
故答案为:1-
.
故答案为:Cu2++CO32-+H2O=Cu(OH)2 ↓+CO2↑或CO32-+H2O?HCO3-+OH-,Cu2++2OH-=Cu(OH)2 ↓;
Ⅱ.沉淀具有吸附能力,可吸附硫酸根离子,通过加入氯化钡的方法进行检验,通常做法是取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净,
故答案为:取最后一次洗涤液,滴加BaCl2溶液,无沉淀生成,说明已洗净;
(1)如有Cu(OH)2,解热时生成水,用无水硫酸铜检验,如白色固体变为蓝色,说明有水生成,故答案为:CuSO4;
(2)如为Cu(OH)2,解热时生成水,则B中无水硫酸铜变蓝,并且C中澄清石灰水不变浑浊,故答案为:B中无水硫酸铜变蓝,C中澄清石灰水不变浑浊;
Ⅲ.(3)若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收,则实验仪器的连接顺序应为C A B E D(或C A B D E),
故答案为:C A B E D(或C A B D E);
(4)为保证样品加热分解生成的二氧化碳和水蒸气完全被吸收,应通入空气,由于空气中含有二氧化碳和水蒸气,应先通过盛有碱石灰的装置B,反应结束后,为防止空气的中二氧化碳和水蒸气被吸收,应在装置的后面连接盛有碱石灰的干燥管,
故答案为:吸收空气中的H2O 蒸汽和CO2;开始时通入处理过的空气可以将装置中原有的H2O 蒸汽和CO2排出;结束时通入处理过的空气可以将装置中滞留的H2O 蒸汽和CO2赶出.
(5)若沉淀样品的质量为m克,装置B质量增加了n克,应为水的质量,发生:Cu(OH)2
| ||
Cu(OH)2
| ||
98g 18g
m(Cu(OH)2) ng
m(Cu(OH)2)=
| 98n |
| 18 |
m(CuCO3)=mg-
| 98n |
| 18 |
ω(CuCO3)=
mg-
| ||
| mg |
| 49n |
| 9m |
则沉淀中CuCO3的质量分数为1-
| 49n |
| 9m |
故答案为:1-
| 49n |
| 9m |
点评:本题考查化学反应机理的探究,题目难度中等,本题注意根据物质的化学性质设计实验方案,易错点为Ⅲ,注意实验时要排除空气中水和二氧化碳的干扰.

练习册系列答案
相关题目

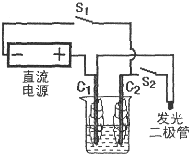 燃料电池是一种将化学反应产生的能量直接转换成电能的装置.某研究性学习小组在一次活动中,参照下图组装实验装置,以外面缠绕棉花的碳棒为电极,电解质溶液用0.5mol?L-1Na2SO4溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA.
燃料电池是一种将化学反应产生的能量直接转换成电能的装置.某研究性学习小组在一次活动中,参照下图组装实验装置,以外面缠绕棉花的碳棒为电极,电解质溶液用0.5mol?L-1Na2SO4溶液,电源用3~6V直流电源,发光二极管起辉电压为1.7V,电流为0.6mA.