题目内容
(2013?资阳模拟)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀.甲同学认为两者反应只生成CuCO3一种沉淀;乙同学认为这两者混合后发生双水解,反应完全,生成Cu(OH)2一种沉淀;丙同学认为生成CuCO3和Cu(OH)2两种沉淀.在探究沉淀物成分前,须将沉淀从溶液中分离并净化,具体操作为:①
Ⅰ、按图1所示装置进行净化后沉淀物成分的测定实验.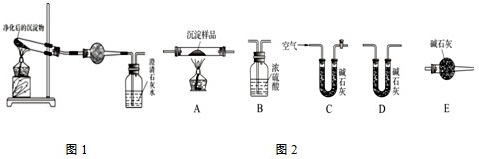
(1)干燥管里应装入的药品为(选填字母代号):
a.碱石灰 b.无水硫酸铜
(2)若只观察到澄清石灰水变浑浊,说明
(3)若沉淀物为Cu(OH)2,则观察到的现象是
Ⅱ、若CuCO3和Cu(OH)2两者都有,可通过图2所示装置进行定量测定其组成.
(1)各装置连接顺序为C→A→
(2)装置C中碱石灰的作用是
(3)若沉淀样品的质量为m g,装置B质量增加了n g,则沉淀中Cu(OH)2的质量分数为
×100%
×100%.
过滤
过滤
、②洗涤、③干燥.Ⅰ、按图1所示装置进行净化后沉淀物成分的测定实验.

(1)干燥管里应装入的药品为(选填字母代号):
b
b
. a.碱石灰 b.无水硫酸铜
(2)若只观察到澄清石灰水变浑浊,说明
甲
甲
同学判断正确.(3)若沉淀物为Cu(OH)2,则观察到的现象是
干燥管中无水硫酸铜变蓝,澄清石灰水无变化
干燥管中无水硫酸铜变蓝,澄清石灰水无变化
.Ⅱ、若CuCO3和Cu(OH)2两者都有,可通过图2所示装置进行定量测定其组成.
(1)各装置连接顺序为C→A→
B
B
→D
D
→E. (2)装置C中碱石灰的作用是
吸收空气中的CO2和水蒸汽
吸收空气中的CO2和水蒸汽
.(3)若沉淀样品的质量为m g,装置B质量增加了n g,则沉淀中Cu(OH)2的质量分数为
| 49n |
| 9m |
| 49n |
| 9m |
分析:沉淀从溶液中分离出的实验操作是过滤、洗涤、干燥;
Ⅰ、(1)图1中干燥管是检验沉淀加热分解后产物中是否含有水蒸气,选择无水硫酸铜检验是否生成水来确定是否含有氢氧化铜;
(2)若只观察到澄清石灰水变浑浊,干燥管无变蓝现象,说明沉淀是碳酸铜;
(3)若沉淀物为Cu(OH)2,加热分解生成氧化铜和水,干燥管中的无水硫酸铜变蓝色说明是含有氢氧化铜;
Ⅱ、若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收;根据质量的增加值计算碳酸铜和氢氧化铜的质量,得到氢氧化铜的质量分数;
Ⅰ、(1)图1中干燥管是检验沉淀加热分解后产物中是否含有水蒸气,选择无水硫酸铜检验是否生成水来确定是否含有氢氧化铜;
(2)若只观察到澄清石灰水变浑浊,干燥管无变蓝现象,说明沉淀是碳酸铜;
(3)若沉淀物为Cu(OH)2,加热分解生成氧化铜和水,干燥管中的无水硫酸铜变蓝色说明是含有氢氧化铜;
Ⅱ、若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收;根据质量的增加值计算碳酸铜和氢氧化铜的质量,得到氢氧化铜的质量分数;
解答:解:①将沉淀从溶液中分离并净化的操作是过滤洗涤,干燥得到沉淀;
故答案为:过滤;
Ⅰ、(1)图1中干燥管是检验沉淀加热分解后产物中是否含有水蒸气,选择无水硫酸铜检验是否生成水来确定是否含有氢氧化铜;
故答案为:b;
(2)若只观察到澄清石灰水变浑浊,干燥管无变蓝现象,说明生成二氧化碳,无水生成,证明沉淀是碳酸铜,甲推断正确;
故答案为:甲;
(3)若沉淀物为Cu(OH)2,受热分解生成固体氧化铜和水蒸气,则观察到的现象是干燥管中的无水硫酸铜变蓝色,石灰水不变浑浊;
故答案为:干燥管中无水硫酸铜变蓝,澄清石灰水无变化;
Ⅱ、(1)若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收,则实验仪器的连接顺序应为C A B E D(或C A B D E),
故答案为:C A B E D(或C A B D E);
(2)为保证样品加热分解生成的二氧化碳和水蒸气完全被吸收,应通入空气,由于空气中含有二氧化碳和水蒸气,应先通过盛有碱石灰的装置C,反应结束后,为防止空气的中二氧化碳和水蒸气被吸收,应在装置的后面连接盛有碱石灰的干燥管,
故答案为:吸收空气中的H2O 蒸汽和CO2;
(3)若沉淀样品的质量为m克,装置B质量增加了n克,应为水的质量,发生:Cu(OH)2
CuO+H2O,
Cu(OH)2
CuO+H2O
98g 18g
m(Cu(OH)2) ng
m(Cu(OH)2)=
g,
m(CuCO3)=mg-
g,
ω(Cu(OH)2)=
×100%=
×100%;
故答案为:
×100%;
故答案为:过滤;
Ⅰ、(1)图1中干燥管是检验沉淀加热分解后产物中是否含有水蒸气,选择无水硫酸铜检验是否生成水来确定是否含有氢氧化铜;
故答案为:b;
(2)若只观察到澄清石灰水变浑浊,干燥管无变蓝现象,说明生成二氧化碳,无水生成,证明沉淀是碳酸铜,甲推断正确;
故答案为:甲;
(3)若沉淀物为Cu(OH)2,受热分解生成固体氧化铜和水蒸气,则观察到的现象是干燥管中的无水硫酸铜变蓝色,石灰水不变浑浊;
故答案为:干燥管中无水硫酸铜变蓝,澄清石灰水无变化;
Ⅱ、(1)若CuCO3和Cu(OH)2两种沉淀都有,加热时生成CO2和H2O,定量检验时,可用浓硫酸吸收水,用碱石灰吸收二氧化碳,实验时,为减小误差,应排除空气中水和二氧化碳的干扰,并保证水和二氧化碳完全吸收,则实验仪器的连接顺序应为C A B E D(或C A B D E),
故答案为:C A B E D(或C A B D E);
(2)为保证样品加热分解生成的二氧化碳和水蒸气完全被吸收,应通入空气,由于空气中含有二氧化碳和水蒸气,应先通过盛有碱石灰的装置C,反应结束后,为防止空气的中二氧化碳和水蒸气被吸收,应在装置的后面连接盛有碱石灰的干燥管,
故答案为:吸收空气中的H2O 蒸汽和CO2;
(3)若沉淀样品的质量为m克,装置B质量增加了n克,应为水的质量,发生:Cu(OH)2
| ||
Cu(OH)2
| ||
98g 18g
m(Cu(OH)2) ng
m(Cu(OH)2)=
| 98n |
| 18 |
m(CuCO3)=mg-
| 98n |
| 18 |
ω(Cu(OH)2)=
| ||
| m |
| 49n |
| 9m |
故答案为:
| 49n |
| 9m |
点评:本题考查了物质性质的探究实验设计和实验分析应用,物质性质的熟练掌握和实验基本操作是解题关键,题目难度中等.

练习册系列答案
相关题目