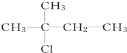
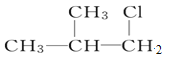
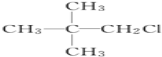
题目内容
【题目】填空题
(1)KHSO4溶液的pH______(填“>”“<”或“=”)7,用离子方程式表示为___________。
(2)KHCO3溶液的pH_____(填“>”“<”或“=”)7,用离子方程式表示为____________。
(3)将上述两种溶液混合,现象是_______________,用离子方程式表示为___________。
【答案】< KHSO4===K++H++SO![]() > HCO
> HCO![]() +H2O==H2CO3+OH- 产生气泡 H++HCO
+H2O==H2CO3+OH- 产生气泡 H++HCO![]() ===H2O+CO2↑
===H2O+CO2↑
【解析】
(1)硫酸氢钾溶液中电离出氢离子,溶液显酸性,据此分析;
(2)碳酸氢钾溶液中存在碳酸氢根离子的水解和电离,水解程度大于电离程度,溶液显碱性,据此分析;
(3)二者混合,反应生成二氧化碳和水,据此分析。
(1).硫酸氢钾电离出氢离子,溶液显酸性,pH <7 ,电离方程式为:KHSO4===K++H++SO![]() ;
;
(2) 碳酸氢钾溶液中存在碳酸氢根离子的水解和电离,水解程度大于电离程度,溶液显碱性,pH>7,水解的离子方程式为:HCO![]() +H2O==H2CO3+OH-;
+H2O==H2CO3+OH-;
(3).硫酸氢钾和碳酸氢钾反应生成硫酸钾和水和二氧化碳,现象为:产生气泡,反应的离子方程式为:H++HCO![]() ===H2O+CO2↑。
===H2O+CO2↑。

练习册系列答案
相关题目