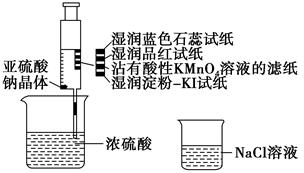
题目内容
下列反应的现象均是溶液褪色,问其中能体现二氧化硫有漂白性的是( )
| A.将SO2气体通入含有氢氧化钠的酚酞溶液中,溶液褪色 |
| B.将SO2气体通入氯水中,溶液褪色 |
| C.将SO2通入品红溶液中,溶液褪色 |
| D.将SO2气体通入酸性高锰酸钾溶液中,溶液褪色 |
C
试题分析:A.SO2是酸性氧化物,能与碱发生反应:SO2+2NaOH=Na2SO3+H2O。由于NaOH被消耗,碱性减弱,所以酚酞溶液变为无色,这是SO2的酸性。错误。B.将SO2气体通入氯水中,溶液褪色是因为发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,这是SO2的还原性。得到的产物都没有漂白性。错误。C.SO2能与某些有色物质如品红结合形成不稳定的无色物质。因此二氧化硫有漂白性。正确。D.将SO2气体通入酸性高锰酸钾溶液中,溶液褪色,发生反应:2KMnO4+ 5SO2+2H2O= K2SO4+2MnSO4+ 2H2SO4。这是SO2的还原性.错误.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
 溶液变蓝色
溶液变蓝色
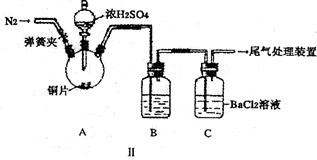
 2SO3(g)反应中,SO2和O2反应速率大小关系
2SO3(g)反应中,SO2和O2反应速率大小关系