题目内容
有一包白色粉末,其中可能含有Na2CO3、NaCl、K2SO4、CuCl2、BaCl2、K2CO3和Na2SO4,现按下列步骤进行实验:?(1)将该粉末溶于水得无色溶液和白色沉淀;?
(2)在滤出的沉淀中加入稀HNO3后,有部分沉淀溶解,同时产生无色气体;?
(3)取滤液做焰色反应,火焰呈黄色,隔着蓝色钴玻璃观察,未见紫色火焰。?
由上述实验现象推断:混合物中一定含有? ?,一定不含有? ?,不能肯定是否含有? ?。?
解析:将该粉末溶于水得无色溶液,一定不含有CuCl2,滤出的沉淀中加入稀HNO3后,有部分沉淀溶解,同时产生无色气体,既有硫酸盐,又有碳酸盐。取滤液做焰色反应,隔着蓝色钴玻璃观察,未见紫色火焰,一定没有钾盐。肯定有Na2CO3、BaCl2、Na2SO4。?
答案:Na2CO3、 BaCl2、 Na2SO4 K2SO4、CuCl2、K2CO3 NaCl

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
相关题目
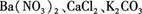 ,现做以下实验。
,现做以下实验。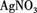 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。 现象,判断白色粉末中一定含有 (填化学式),可能含自 (填化学式)。写出(3)中有关反应的离子方程式 。
现象,判断白色粉末中一定含有 (填化学式),可能含自 (填化学式)。写出(3)中有关反应的离子方程式 。