题目内容
有一包白色粉末,其中可能Na2CO3、BaCl2、K2SO4、NaCl,现做以下实验:①将部分粉末加入水中,振荡,有白色沉淀生成;
②向(1)的悬浊液中加入过量稀硝酸,白色沉淀部分消失,并有气泡生成;
③取少量(2)的溶液滴入AgNO3溶液,有白色沉淀生成.
回答下列问题:
(1)综合上述实验现象,判断原白色粉末中肯定含有
(2)写出第②步反应的离子方程式:
分析:①将部分粉末加入水中,振荡,有白色沉淀生成,白色沉淀可能为硫酸钡、碳酸钡,白色粉末可能为Na2CO3、BaCl2、K2SO4;
②向(1)的悬浊液中加入过量稀硝酸,白色沉淀部分消失,并有气泡生成,说明一定含有Na2CO3、BaCl2、K2SO4;
③取少量(2)的溶液滴入AgNO3溶液,有白色沉淀生成,白色沉淀为氯化银,由于存在氯化钡,所以无法确定是否含有氯化钠,
根据以上分析进行解答即可.
②向(1)的悬浊液中加入过量稀硝酸,白色沉淀部分消失,并有气泡生成,说明一定含有Na2CO3、BaCl2、K2SO4;
③取少量(2)的溶液滴入AgNO3溶液,有白色沉淀生成,白色沉淀为氯化银,由于存在氯化钡,所以无法确定是否含有氯化钠,
根据以上分析进行解答即可.
解答:解:①加入水中,振荡,有白色沉淀生成,白色粉末可能为Na2CO3、BaCl2、K2SO4;
②向①的悬浊液中加入过量稀硝酸,白色沉淀部分消失,说明白色沉淀为硫酸钡和碳酸钡,白色粉末中一定含有Na2CO3、BaCl2、K2SO4;有气泡生成,气泡为二氧化碳,说明一定含有碳酸钠;
③由于白色粉末中含有氯化钡,所以不能确定是否含有氯化钠;
(1)根据以上分析可知,白色粉末中一定含有:Na2CO3、BaCl2、K2SO4;可能含有NaCl,
故答案为:Na2CO3、BaCl2、K2SO4;NaCl;
(2)②中滴入硝酸银溶液后,氯离子与银离子反应生成了氯化银沉淀,反应的离子方程式为:Ag++Cl-=AgCl↓,
故答案为:.
②向①的悬浊液中加入过量稀硝酸,白色沉淀部分消失,说明白色沉淀为硫酸钡和碳酸钡,白色粉末中一定含有Na2CO3、BaCl2、K2SO4;有气泡生成,气泡为二氧化碳,说明一定含有碳酸钠;
③由于白色粉末中含有氯化钡,所以不能确定是否含有氯化钠;
(1)根据以上分析可知,白色粉末中一定含有:Na2CO3、BaCl2、K2SO4;可能含有NaCl,
故答案为:Na2CO3、BaCl2、K2SO4;NaCl;
(2)②中滴入硝酸银溶液后,氯离子与银离子反应生成了氯化银沉淀,反应的离子方程式为:Ag++Cl-=AgCl↓,
故答案为:.
点评:本题考查物质的检验与鉴别,该题是高考中的常见题型,属于中等难度的试题,注意进行物质的检验时,要依据物质的特殊性质和特征反应,准确根据反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
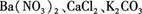 ,现做以下实验。
,现做以下实验。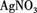 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。 现象,判断白色粉末中一定含有 (填化学式),可能含自 (填化学式)。写出(3)中有关反应的离子方程式 。
现象,判断白色粉末中一定含有 (填化学式),可能含自 (填化学式)。写出(3)中有关反应的离子方程式 。