题目内容
下列反应的离子反应方程式错误的是
- A.硫酸镁溶液和氢氧化钡溶液反应:SO42-+Ba2+BaSO4↓
- B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-BaCO3↓+NH3?H2O+H2O
- C.氢氧化铝与足量的氢氧化钠溶液反应:Al(OH)3+OH-AlO2-+2H2O
- D.向苯酚钠溶液中能入CO2:C6H5-O-+CO2+H2O→C6H5-OH+HCO3-
A
分析:A、依据产物中会生成氢氧化镁沉淀分析判断;
B、依据铵根离子和碳酸氢根离子和氢氧根离子都能反应分析判断;
C、氢氧化铝可以溶于强碱溶液分析判断;
D、依据苯酚具有酸性和碳酸钠溶液反应生成碳酸氢钠分析判断.
解答:A、硫酸镁溶液和氢氧化钡溶液反应生成硫酸钡沉淀和氢氧化镁沉淀,离子方程式为Mg2++2OH-+SO42-+Ba2+=BaSO4↓+Mg(OH)2↓,故A错误;
B、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合,氢氧根离子恰好和铵根离子和碳酸氢根离子反应,离子方程式为Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O,故B正确;
C、氢氧化铝与足量的氢氧化钠溶液反应,氢氧化铝溶于强碱溶液中生成偏铝酸盐,离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故C正确;
D、向苯酚钠溶液中能入CO2,苯酚具有酸性和碳酸钠反应生成碳酸氢钠所以反应的离子方程式只能生成碳酸氢盐,离子方程式为C6H5-O-+CO2+H2O→C6H5-OH+HCO3-故D正确;
故选A.
点评:本题考查了离子方程式的书写原则,注意电荷守恒和原子守恒,关键是离子反应的顺序判断,苯酚的酸性和碳酸钠反应生成碳酸氢钠.
分析:A、依据产物中会生成氢氧化镁沉淀分析判断;
B、依据铵根离子和碳酸氢根离子和氢氧根离子都能反应分析判断;
C、氢氧化铝可以溶于强碱溶液分析判断;
D、依据苯酚具有酸性和碳酸钠溶液反应生成碳酸氢钠分析判断.
解答:A、硫酸镁溶液和氢氧化钡溶液反应生成硫酸钡沉淀和氢氧化镁沉淀,离子方程式为Mg2++2OH-+SO42-+Ba2+=BaSO4↓+Mg(OH)2↓,故A错误;
B、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合,氢氧根离子恰好和铵根离子和碳酸氢根离子反应,离子方程式为Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O,故B正确;
C、氢氧化铝与足量的氢氧化钠溶液反应,氢氧化铝溶于强碱溶液中生成偏铝酸盐,离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故C正确;
D、向苯酚钠溶液中能入CO2,苯酚具有酸性和碳酸钠反应生成碳酸氢钠所以反应的离子方程式只能生成碳酸氢盐,离子方程式为C6H5-O-+CO2+H2O→C6H5-OH+HCO3-故D正确;
故选A.
点评:本题考查了离子方程式的书写原则,注意电荷守恒和原子守恒,关键是离子反应的顺序判断,苯酚的酸性和碳酸钠反应生成碳酸氢钠.

练习册系列答案
相关题目
(14分))某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。
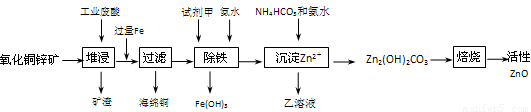
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
|
离子 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Fe2+ |
6.34 |
9.7 |
|
Fe3+ |
1.48 |
3.2 |
|
Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,这是由于相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的 (填序号)作为试剂甲是比较合适的。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方
程式 。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __ mol/L以下。
[Fe(OH)3的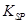 = 2.70×10-39]
= 2.70×10-39]
(6)乙的溶液可直接用作氮肥,则乙的化学式是 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式 。
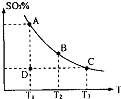 (1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题:
(1)在硫酸生产中,SO2催化氧化生成SO3是反应的关键,其反应的化学方程式为:2SO2(g)+O2(g)?2SO2(g),反应混合体系SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态),根据图示回答下列问题: