��Ŀ����
����Ŀ��������25�桢101kPaʱ����1Lˮ�п��ܽ�0.09mol��ʵ��������ˮ��Cl2Լ��![]() ��ˮ��Ӧ����ش��������⣺
��ˮ��Ӧ����ش��������⣺
��1���÷�Ӧ�����ӷ���ʽΪ________��
��2����÷�Ӧ��ƽ�ⳣ��Ϊ________���������ӷ���ʽ���㣩��
��3��������ƽ����ϵ�м�������KOH���壬ƽ�⽫________���������Ӧ���������淴Ӧ���������ƶ���
��4���������������ѹǿ��������ˮ�е��ܽ�Ƚ�________�����������С�����䡱����ƽ�⽫________���������Ӧ���������淴Ӧ���������ƶ���
���𰸡� Cl2+H2O![]() H++Cl��+HClO 4.5��10��4 ����Ӧ���� ���� ����Ӧ����
H++Cl��+HClO 4.5��10��4 ����Ӧ���� ���� ����Ӧ����
��������
��1��������ˮ��Ӧ��������ʹ����ᣬ��������������ʣ�
��2����1Lˮ�п��ܽ�0.09mol��������������Ũ��Ϊ0.09mol/L�����ƽ�����ƽ��״̬����Ũ�ȣ�����ƽ�ⳣ���������õ���
��3�������������ƣ���Һ�е����������Ӻ������ӷ�Ӧ��ƽ��������У�
��4�������ܽ����ѹǿ���������ƽ�������������С�ķ�����С�
��1��������ˮ��Ӧ��������ʹ����ᣬ��Ӧ�����ӷ���ʽΪCl2+H2O![]() H++Cl��+HClO��
H++Cl��+HClO��
��2����1Lˮ�п��ܽ�0.09mol��������������Ũ��Ϊ0.09mol/L������ƽ������ʽ��ʽ����õ�ƽ��Ũ�ȣ�
Cl2+H2O![]() H++Cl��+HClO
H++Cl��+HClO
��ʼŨ�ȣ�mol/L�� 0.09 0 0 0
ת��Ũ�ȣ�mol/L�� 0.03 0.03 0.03 0.03
ƽ��Ũ�ȣ�mol/L�� 0.06 0.03 0.03 0.03
K=![]() =4.5��10��4��
=4.5��10��4��
��3��������ƽ����ϵ�м�������NaOH���壬���ƽ��״̬�µ������ӷ�Ӧ��������Ũ�ȼ�С��ƽ��������У�
��4��������ƽ���м�ѹ��ƽ�������������С�ķ�Ӧ������У�ƽ��������Ӧ�����ƶ����������ܽ��������ӡ�

����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϡ���ҵ�����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2) �ڴ����������ºϳɼ״�������������Ӧ����:
��CO(g)+2H2(g) ![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ��H=-58kJ/mol
CH3OH(g)+H2O(g) ��H=-58kJ/mol
��CO2(g)+H2(g) ![]() CO(g)+H2O(g) ��H=+41kJ/mol
CO(g)+H2O(g) ��H=+41kJ/mol
�ش���������:
(1)��֪��Ӧ���е���صĻ�ѧ��������������:
��ѧ�� | H-H | C-O | C=O | H-O | C-H |
E/(kJ/mol) | a | b | c | d | x |
��x=______�����ú�������ĸ�Ĵ���ʽ��ʾ��
(2)����lmolCO2��2molH2�����ݻ�Ϊ2L�ĺ����ܱ������У������ֲ�ͬ�¶��·�����Ӧ�ڡ����CH3OH�����ʵ�����ʱ��ı仯��ͼ��ʾ��
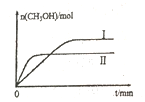
�����ߢ��Ӧ��ƽ�ⳣ����С��ϵΪK��_____K��(�>��=����<��)
��һ���¶���,���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����______��
a.������ѹǿ����
b.�״���ˮ����������ȱ��ֲ���
c.v��(H2)=3v��(CH3OH)
d.2��C=O���ѵ�ͬʱ��3��H-H�γ�
����5min��Ӧ�ﵽƽ��״̬��H2��ת����Ϊ90%������CO2��ʾ��ƽ����Ӧ����Ϊ_____�����¶��µ�ƽ�ⳣ��Ϊ_____���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���____��
a.�����¶� b.ʹ�ú��ʵĴ��� c.����He d.��ԭ�����ٳ���CO2��H2