题目内容
下图是Na2O2和CO2定性、定量实验的装置示意图。
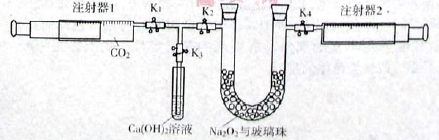
注射器1中抽取了100mL CO2,U型管中装有适量小玻璃珠和约1.5g Na2O2粉末。实验开始时,打开K1、K2、K4止水夹,关闭K3止水夹,推动注射器1活塞,缓缓将CO2压至U型管,注射器2活塞缓缓向外移动。回答下列问题:(本题不考虑注射器内壁的磨擦阻力)
(1)U型管内的玻璃珠并不参与反应,其所起的作用除防止过氧化钠粉末被吹走外,另一个重要作用是 。
(2)U型管中可观察到的反应现象是 。
(3)注射器I活塞推到底后,注射器2中收集到的气体大于50mL,其原因除可能仍还含CO2外,还有一个重要原因是 。
(4)为了使剩余气体中二氧化碳能反应完,接下来的操作是 。
(5)要证明反应产物之一为氧气,最为方便的实验方法是 。
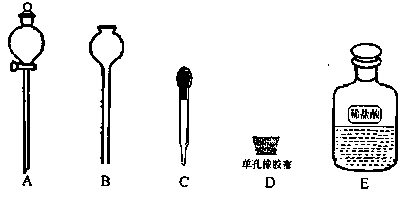
(6)本实验结束后固体产物板结,难以从U型管中取出,为了要证明固体产物中含有碳酸盐,实验时还需要从如下图示仪器和试剂中选择 (填字母)。当装置和药品都安装完毕后,接下来的操作步骤是 。

注射器1中抽取了100mL CO2,U型管中装有适量小玻璃珠和约1.5g Na2O2粉末。实验开始时,打开K1、K2、K4止水夹,关闭K3止水夹,推动注射器1活塞,缓缓将CO2压至U型管,注射器2活塞缓缓向外移动。回答下列问题:(本题不考虑注射器内壁的磨擦阻力)
(1)U型管内的玻璃珠并不参与反应,其所起的作用除防止过氧化钠粉末被吹走外,另一个重要作用是 。
(2)U型管中可观察到的反应现象是 。
(3)注射器I活塞推到底后,注射器2中收集到的气体大于50mL,其原因除可能仍还含CO2外,还有一个重要原因是 。
(4)为了使剩余气体中二氧化碳能反应完,接下来的操作是 。
(5)要证明反应产物之一为氧气,最为方便的实验方法是 。
(6)本实验结束后固体产物板结,难以从U型管中取出,为了要证明固体产物中含有碳酸盐,实验时还需要从如下图示仪器和试剂中选择 (填字母)。当装置和药品都安装完毕后,接下来的操作步骤是 。

(15分)
增大过氧化钠和二氧化碳的接触面,使反应完全(2分)。
淡黄色粉末渐渐变白(2分)。
该反应为放热反应,使反应后气体温度升高,体积变大(2分)。
将注射器2中气体再推入U型管,反复数次(2分)。
打开胶塞,立即将带有火星的木条伸入U型管中,木条复燃(2分)。
DEA(或DEC)(2分)
关闭K1、K4止水夹,打开K2、K3止水夹;打开分液漏斗活塞将稀盐酸滴入U型管中,观察试管内Ca(OH)2溶液是否变浑浊(3分)。
增大过氧化钠和二氧化碳的接触面,使反应完全(2分)。
淡黄色粉末渐渐变白(2分)。
该反应为放热反应,使反应后气体温度升高,体积变大(2分)。
将注射器2中气体再推入U型管,反复数次(2分)。
打开胶塞,立即将带有火星的木条伸入U型管中,木条复燃(2分)。
DEA(或DEC)(2分)
关闭K1、K4止水夹,打开K2、K3止水夹;打开分液漏斗活塞将稀盐酸滴入U型管中,观察试管内Ca(OH)2溶液是否变浑浊(3分)。
试题分析:
(1)过氧化钠分散在玻璃珠中,有利于增大过氧化钠与二氧化碳的接触面积,使反应更充分。
(2)过氧化钠与二氧化碳生成碳酸钠和氧气,过氧化钠为淡黄色固体、碳酸钠为白色固体。
(3)由2Na2O2+2CO2=2Na2CO3+O2知100mLCO2生成50mLO2,注射器2中收集到气体的体积大于50mL说明气体体积膨胀,推测过氧化钠与二氧化碳的反应放热。
(4)将注射器2中混合气体继续通入U型管,使二氧化碳反应完全。
(5)用带火星木条检验氧气。
(6)证明含有碳酸盐,可以向固体中加入盐酸,检验生成的二氧化碳气体。

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目