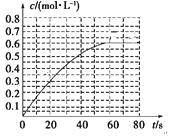
题目内容
【题目】用NaOH溶液吸收烟气中的SO2 , 将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4 , 其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是( )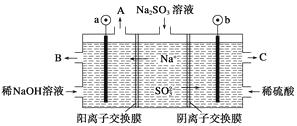
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:![]() -2e-+H2O=
-2e-+H2O=![]() +2H+
+2H+
D.电解过程中阴极区碱性明显增强
【答案】B
【解析】根据Na+、SO的移向判断阴、阳极。Na+移向阴极区,SO32-移向阳极区,所以a极应接电源负极,阴极电极反应式为2H2O+2e-===H2↑+2OH-;b极应接电源正极,阳极电极反应式为![]() -2e-+H2O==
-2e-+H2O==![]() +2H+。所以A口放出的物质是氢气,从C口流出的是浓度较大的硫酸。在阴极区,由于H+放电,破坏水的电离平衡,c(H+)减小,c(OH-)增大,生成NaOH,碱性增强。故A、C、D项均正确,B项错误。
+2H+。所以A口放出的物质是氢气,从C口流出的是浓度较大的硫酸。在阴极区,由于H+放电,破坏水的电离平衡,c(H+)减小,c(OH-)增大,生成NaOH,碱性增强。故A、C、D项均正确,B项错误。

练习册系列答案
相关题目