题目内容
醋酸是重要的一元酸,在有机和无机反应中都有应用.现有25℃时pH=3的醋酸。请回答下列问题:
(1)若向醋酸中加入少量醋酸钠固体,此时溶液中c(H+)/c(CH3COOH)将
(填“增大”、“减小”或“不变”)。
(2) 若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH 7
(填“>”、“<”或“=”);用离子方程式表示其原因 。
(3)若向醋酸中加入稀NaOH溶液至溶液恰好呈中性,此时c(Na+) c(CH3COO-)(填“>”“<”“=”)。
【答案】
(1) 减小 。(2) > ,
CH3COO- +H2O CH3COOH +H+ 。(3)
= 。
CH3COOH +H+ 。(3)
= 。
【解析】
试题分析:(1)在醋酸中存在着已下电离,CH3COOH CH3COO-+H+,所以加入醋酸钠固体,增加了CH3COO-,由于温度不变所以,醋酸的电离常数不变,即K=c(CH3COO-)c(H+)/c(CH3COOH),c(CH3COO-)变大,所以c(H+)/c(CH3COOH)将变小;(2)醋酸为弱酸,而NaOH为强碱,所以若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH>7,其原因是由于醋酸根离子的水解,其水解的方程式为CH3COO- +H2O
CH3COO-+H+,所以加入醋酸钠固体,增加了CH3COO-,由于温度不变所以,醋酸的电离常数不变,即K=c(CH3COO-)c(H+)/c(CH3COOH),c(CH3COO-)变大,所以c(H+)/c(CH3COOH)将变小;(2)醋酸为弱酸,而NaOH为强碱,所以若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH>7,其原因是由于醋酸根离子的水解,其水解的方程式为CH3COO- +H2O CH3COOH +H+ ,(3)根据电荷平衡可以得到,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),由于溶液恰好呈中性,即c(H+)=c(OH-),
CH3COOH +H+ ,(3)根据电荷平衡可以得到,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),由于溶液恰好呈中性,即c(H+)=c(OH-),
所以c(Na+)=c(CH3COO-)。
考点:盐类水解,水解常数
点评:本题考查了盐类水解,水解常数,该考点是高考考查的重点和热点,本题要注意水解常数只跟温度有关,该题难度适中。

练习册系列答案
相关题目
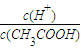 将______(填“增大”、“减小”或“不变”).
将______(填“增大”、“减小”或“不变”).