题目内容
醋酸是重要的一元酸,在有机和无机反应中都有应用.现有25℃时pH=3的醋酸.请回答下列问题:
(1)若向醋酸中加入少量醋酸钠固体,此时溶液中
将
(2)若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH
(3)若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是:
(4)若向醋酸中加入稀NaOH溶液至溶液恰好呈中性,此时c(Na+)
(5)若向醋酸中加入一定量的NaOH溶液,所得混合溶液的pH=6,则此溶液中c(CH3COO-)-c(Na+)=
(1)若向醋酸中加入少量醋酸钠固体,此时溶液中
| c(H+) | c(CH3COOH) |
减小
减小
(填“增大”、“减小”或“不变”).(2)若向醋酸中加入稀NaOH溶液,使其恰好完全反应,所得溶液的pH
>
>
7(填“>”、“<”或“=”);用离子方程式表示其原因CH3COO-+H2O?CH3COOH+OH-
CH3COO-+H2O?CH3COOH+OH-
.(3)若向醋酸中加入pH=11的NaOH溶液,且二者的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
.(4)若向醋酸中加入稀NaOH溶液至溶液恰好呈中性,此时c(Na+)
=
=
c(CH3COO-)(填“>”“<”“=”).(5)若向醋酸中加入一定量的NaOH溶液,所得混合溶液的pH=6,则此溶液中c(CH3COO-)-c(Na+)=
(10-6-10-8)mol/L
(10-6-10-8)mol/L
(填写准确数据).分析:(1)根据醋酸钠固体对平衡CH3COOH?CH3COO-+H+的影响分析.
(2)恰好反应溶液为NaAc溶液,NaAc是强碱弱酸盐,强碱弱酸盐要发生水解呈碱性.
(3)醋酸过量,溶液中的成分为醋酸和醋酸钠,根据醋酸的电离程度大于醋酸钠的水解程度来解答.
(4)根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)判断.
(5)pH=6溶液中,c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)计算.
(2)恰好反应溶液为NaAc溶液,NaAc是强碱弱酸盐,强碱弱酸盐要发生水解呈碱性.
(3)醋酸过量,溶液中的成分为醋酸和醋酸钠,根据醋酸的电离程度大于醋酸钠的水解程度来解答.
(4)根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)判断.
(5)pH=6溶液中,c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)计算.
解答:解:(1)因醋酸钠固体电离产生CH3COO-,c(CH3COO-)增大,使的平衡CH3COOH?CH3COO-+H+逆向移动,C(H+)减小,
C(CH3COOH)增大,所以
减小.
故答案为:减小;
(2)向醋酸中加入稀NaOH溶液,使其恰好完全反应,生成了醋酸钠,醋酸根水解CH3COO-+H2O?CH3COOH+OH-,溶液呈碱性,即PH>7.
故答案为:>;CH3COO-+H2O?CH3COOH+OH-.
(3)醋酸过量,溶液中的成分为醋酸和醋酸钠,因醋酸的电离程度大于醋酸钠的水解程度,溶液出酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(4)液恰好呈中性,则c(H+)=c(OH-),根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故c(Na+)=c(CH3COO-).
故答案为:=.
(5)pH=6溶液中,c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=(10-6-10-8)mol/L.
故答案为:(10-6-10-8)mol/L.
C(CH3COOH)增大,所以
| c(H+) |
| c(CH3COOH) |
故答案为:减小;
(2)向醋酸中加入稀NaOH溶液,使其恰好完全反应,生成了醋酸钠,醋酸根水解CH3COO-+H2O?CH3COOH+OH-,溶液呈碱性,即PH>7.
故答案为:>;CH3COO-+H2O?CH3COOH+OH-.
(3)醋酸过量,溶液中的成分为醋酸和醋酸钠,因醋酸的电离程度大于醋酸钠的水解程度,溶液出酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
故答案为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-).
(4)液恰好呈中性,则c(H+)=c(OH-),根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故c(Na+)=c(CH3COO-).
故答案为:=.
(5)pH=6溶液中,c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)可知,c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=(10-6-10-8)mol/L.
故答案为:(10-6-10-8)mol/L.
点评:考查弱电解质的电离平衡、盐类水解、离子浓度比较、溶液PH值的判断等,难度中等,注意离子浓度比较中等量关系电荷守恒、物料守恒、质子恒等式的利用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
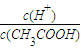 将______(填“增大”、“减小”或“不变”).
将______(填“增大”、“减小”或“不变”).