题目内容
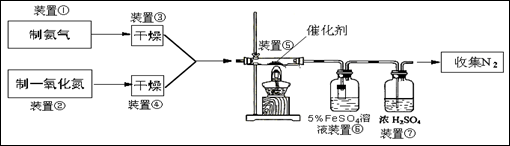
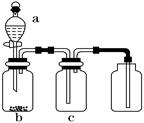
某校化学学习小组拟验证NO能被氨气还原并测定其转化率,设计如下实验:
参考知识:NO气体与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(+2价):NO+FeSO4=Fe(NO)SO4
试回答下列问题:
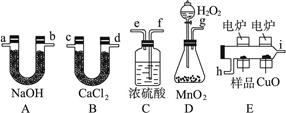
⑴ 可用上图中装置 (填编号,多选)进行氨气的实验室制备。
D装置可用于下列 (填编号,多选)气体的制备。
a CO2 b O2 c SO2 d C2H4 e C2H2 f H2
⑵ 装置③、④若用同一装置,则该装置中所盛装的药品是 (填编号)
⑶ 装置⑥中,粗玻璃管X的作用 ,装置⑦的作用
⑷ 装置⑥的广口瓶中,除生成Fe(NO)SO4外,还有白色沉淀生成,写出生成该沉淀的离子方程式
⑸ 当进入装置⑤的NO为2.688L(标准状况,下同),氨气过量,最后收集到2.016LN2,则NO的转化率为 。
参考知识:NO气体与FeSO4溶液反应生成可溶性硫酸亚硝基合铁(+2价):NO+FeSO4=Fe(NO)SO4

试回答下列问题:

⑴ 可用上图中装置 (填编号,多选)进行氨气的实验室制备。
D装置可用于下列 (填编号,多选)气体的制备。
a CO2 b O2 c SO2 d C2H4 e C2H2 f H2
⑵ 装置③、④若用同一装置,则该装置中所盛装的药品是 (填编号)
| A.氯化钙 | B.浓硫酸 | C.五氧化二磷 | D.碱石灰 |
⑷ 装置⑥的广口瓶中,除生成Fe(NO)SO4外,还有白色沉淀生成,写出生成该沉淀的离子方程式
⑸ 当进入装置⑤的NO为2.688L(标准状况,下同),氨气过量,最后收集到2.016LN2,则NO的转化率为 。
(9分)(1)ABC(2分) af(1分) (2) D(1分)
(3)防止倒吸(1分);除去未反应的氨气并干燥N2(1分)
(4)Fe2++2NH3+2H2O=Fe(OH)2↓+2NH4+ (1分) (5)90% (2分)
(3)防止倒吸(1分);除去未反应的氨气并干燥N2(1分)
(4)Fe2++2NH3+2H2O=Fe(OH)2↓+2NH4+ (1分) (5)90% (2分)
试题分析:(1)实验室制备氨气可以用熟石灰与氯化铵加热,即装置A正确;也可以将氨水滴入到生石灰或碱石灰中,则B正确,或者直接加热浓氨水,C可以,答案选ABC。D装置是简易启普发生器,可以原来制备氢气和CO2,答案选af。
(2)氨气是碱性气体,则不能用酸性干燥剂,也不能用氯化钙干燥氨气,则答案选D。
(3)氨气极易溶于水,所以装置⑥中,粗玻璃管X的作用防止倒吸;要收集氮气,则需要除去氮气中的氨气,所以浓硫酸的作用是除去未反应的氨气并干燥N2。
(4)氨气溶于水生成氨水,溶液显碱性,和亚铁离子反应生成氢氧化亚铁白色沉淀,反应的离子方程式是Fe2++2NH3+2H2O=Fe(OH)2↓+2NH4+。
(5)NO的物质的量是2.688L÷22.4L/mol=0.12mol,氮气的物质的量是2.016L÷22.4L/mol=0.09mol,则根据反应的方程式4NH3+6NO=5N2+6H2O可知消耗NO是0.108mol,所以NO的转化率是
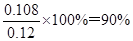 。
。点评:该题是高考中的常见考点和题型,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养。该题的关键是明确实验原理,并能结合装置灵活运用即可。

练习册系列答案
相关题目
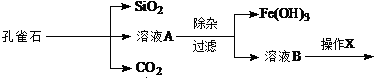
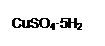 为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下: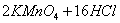 (浓)="==="
(浓)="===" 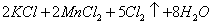 ,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。
,在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。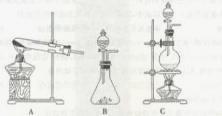
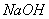 溶液吸收氯气防止污染,写出该反应的离子方程式 。
溶液吸收氯气防止污染,写出该反应的离子方程式 。