题目内容
高铁酸钾是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂.工业是先制得高铁酸钠,然后在低温下,往高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4).湿法制备的主要反应为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O,干法制备的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑下列有关说法不正确的是( )
| A、高铁酸钾中铁显+3价 | B、湿法中每生成1mol Na2FeO4 转移3mol电子 | C、干法中每生成1mol Na2FeO4 转移4mol电子 | D、K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质 |
分析:据化合价代数和为0判断各元素的化合价,根据化合价的变化计算转移的电子数目即可,再氧化还原反应中,化合价升高值=化合价降低值=转移电子数.
解答:解:A、根据化合价代数和为0的原则可知,高铁酸钾中铁显+6价,故A错误;
B、湿法中每生成1molNa2FeO4,有1molFe(OH)3参加反应,化合价由+3价升高到+6价,转移电子3mol,故B正确;
C、干法中每生成1molNa2FeO4,有1molFeSO4参加反应,化合价由+2价升高到+6价,还有Na2O2中的氧由-1价升高到0价的O2,转移电子为4+1=5mol,故C错误;
D、K2FeO4具有强氧化性,可用于消毒杀菌,被还原为Fe3+,水解生成Fe(OH)3,具有吸附性,可用于吸附水中的悬浮杂质,故D正确.
故选AC.
B、湿法中每生成1molNa2FeO4,有1molFe(OH)3参加反应,化合价由+3价升高到+6价,转移电子3mol,故B正确;
C、干法中每生成1molNa2FeO4,有1molFeSO4参加反应,化合价由+2价升高到+6价,还有Na2O2中的氧由-1价升高到0价的O2,转移电子为4+1=5mol,故C错误;
D、K2FeO4具有强氧化性,可用于消毒杀菌,被还原为Fe3+,水解生成Fe(OH)3,具有吸附性,可用于吸附水中的悬浮杂质,故D正确.
故选AC.
点评:本题考查氧化还原反应,题目难度中等,注意不同制备方法的反应原理,把握元素化合价的判断方法,从化合价变化的角度分析氧化还原反应.

练习册系列答案
相关题目
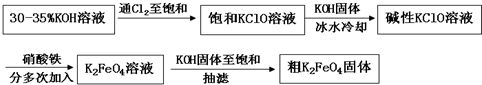
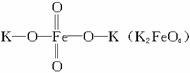 是一种新型、高效、多功能水处理剂,比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。湿法制备的主要方程式为:2Fe(OH)3+2ClO-+4OH-====2
是一种新型、高效、多功能水处理剂,比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中加入KOH至饱和就可析出高铁酸钾(K2FeO4)。湿法制备的主要方程式为:2Fe(OH)3+2ClO-+4OH-====2
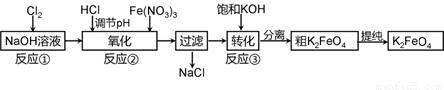
 4Fe(OH)3
+ 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
4Fe(OH)3
+ 8OH- + 3O2。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。