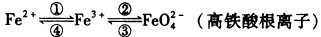题目内容
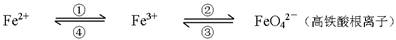
(6分)铁及其化合物之间的相互转化可用下式表示: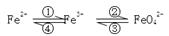
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S(CuFeS2中S为-2价)。
则下列说法正确的是 (选填序号);
a.从物质的组成来看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol e- 时,有46 g CuFeS2参加反应
(3)高铁酸钾是一种新型、高效的绿色净水剂,其净水原理是 。
(6分)
(1)d(2分) (2)d(2分)
(3)高铁酸钾具有强氧化性,可以杀菌、消毒(1分),同时生成的Fe3+离子转化为Fe(OH)3胶体,能加速悬浮物沉降,起净化作用(1分)。
解析试题分析:(1)要使产物纯净,必须物质间发生反应后,没有杂质生成。A项有氯离子杂质生成,错误;b项铁与稀硫酸反应生成二价铁离子,不能把二价铁离子转化为三价铁离子,错误;c项硝酸能氧化二价铁离子生成三价铁离子,但溶液中还有杂质硝酸根离子,错误;d项双氧水能氧化二价铁离子生成三价铁离子,同时有水生成,水是原溶液的成分,所以不是杂质,正确。故选d。
(2)a项合金是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质,所以黄铜矿不是合金,错误;b项CuFeS2中铁元素的化合价为+2价,生成物中Fe2+的化合价为+2价,所以不是所有铁元素均被还原,错误;c项CuFeS2中只有S元素的化合价只有降低,其他元素的化合价不变,所以CuFeS2只作还原剂,错误;d项根据反应CuFeS2+4Fe3+=Cu2++5Fe2++2S,在这个反应中转移4mol电子,生成184g CuFeS2。则转移1 mol e- 时,有 46g CuFeS2参加反应。故d正确。
(3)高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质,所以高铁酸钾作为水处理剂发挥的作用是净水、消毒。
考点:铁盐和亚铁盐的相互转变;氧化还原反应。
点评:本题考查了铁盐和亚铁盐的相互转化,难度不大,注意二价铁离子和三价铁离子的检验是高考的热点,三价铁离子能使KSCN变红色。

 名校课堂系列答案
名校课堂系列答案 铁及其化合物之间的相互转化可用下式表示:①②③④
铁及其化合物之间的相互转化可用下式表示:①②③④