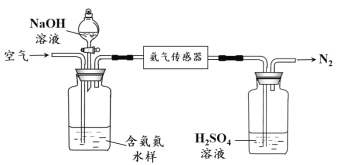
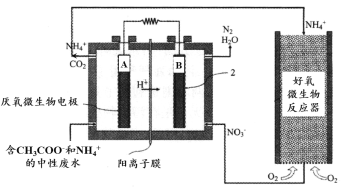
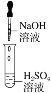
题目内容
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水、易吸潮等性质。实验室用工业大理石(含少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下(已知步骤Ⅲ的滤液中不含![]() )。
)。
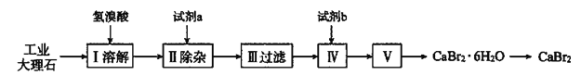
下列说法错误的是( )
A.试剂a可以是生石灰,试剂b是氢溴酸
B.步骤V所含的操作依次是蒸发浓缩、冷却结晶、过滤、洗涤、干燥
C.为将杂质离子除尽,步骤Ⅱ需加过量试剂a,保证溶液呈强碱性
D.工业上常用氨气与溴、石灰乳反应制取溴化钙,若反应中氧化剂与还原剂的物质的量比为3∶2,则产物中会生成一种无色气体
【答案】C
【解析】
工业大理石(含少量Al3+、Fe3+等杂质)制备溴化钙,工业大理石加入氢溴酸溶液生成溴化钙、溴化铝、溴化铁,然后向溶液中加入试剂a,目的是除去Al3+、Fe3+等杂质,除杂质不能引入新杂质,Al3+、Fe3+能与碱反应生成沉淀,a可选取氢氧化钙或生石灰,反应后过滤,滤去沉淀,向滤液中加入试剂b,目的是除去过量的碱,最后溶液经过蒸发浓缩、冷却结晶,过滤得到CaBr2H2O,再进行加热,得到纯净的溴化钙。
A.由分析可知,试剂a,目的是除去Al3+、Fe3+等杂质,可以是生石灰,试剂b,目的是除去过量的碱,除杂质不能引入新杂质,因为最后要制取溴化钙,试剂b是氢溴酸,A正确;
B.要从溶液中得到溴化钙,步骤V所含的操作依次是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,B正确;
C.步骤Ⅱ需加过量生石灰,溶液呈强碱性,会发生反应:Al3++4OH-=[Al(OH)4]-,导致Al3+无法除去,C错误;
D.氨气与溴、石灰乳反应制取溴化钙,反应中氧化剂为溴单质,还原剂为氨气,反应中1mol溴得到2mol电子,设溴的物质的量为3mol,得到的电子为6mol,还原剂氨气中氮的化合价为-3 ,根据得失电子守恒,2mol氨气要失去6mol电子,氮元素就要由-3价变为0价生成氮气,氮气为无色气体,D正确;
答案选C。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
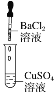
小学同步三练核心密卷系列答案【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝绿色 | 有无色气泡产生 |
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中发生的反应是离子反应
D.Ⅲ中发生反应的离子方程式为2H++Zn=Zn2++H2↑