题目内容
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低.某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列说法不正确的是( ) 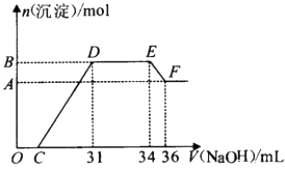
A.OC段离子反应方程式为H++OH﹣═H2O
B.溶液中n(NH ![]() )=0.012 mol
)=0.012 mol
C.溶液中结合OH﹣能力最强的离子是H+ , 最弱的离子是Al3+
D.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
【答案】C
【解析】解:铁铝合金与足量很稀HNO3充分反应,被氧化为Al3+、Fe3+ , 通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,由于硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了﹣3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:①H++OH﹣=H2O,②Fe3++3OH﹣=Fe(OH)3↓,Al3++3OH﹣=Al(OH)3↓,③NH4++OH﹣═NH3H2O,④Al(OH)3 +OH﹣=AlO2﹣+2H2O, A.由上述分析可知,OC段为剩余的硝酸与氢氧化钠反应,离子反应方程式:H++OH﹣=H2O,故A正确;
B.由图可知DE段消耗氢氧化钠的体积为3mol,由NH4++OH﹣═NH3H2O可知溶液中n(NH4+)=n(OH﹣)=0.003L×4mol/L=0.012mol,故B正确;
C.根据发生反应的顺序可知,结合OH﹣能力最强的离子是H+ , 最弱的离子是NH4+ , 故C错误;
D.欲测定F点沉淀的质量,应将互不相溶的固体与液体分离,并洗涤沉淀附着的杂化,再干燥称量,故实验步骤是:过滤、洗涤、干燥、称量,故D正确;
故选C.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案