题目内容
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图,回答下列问题: 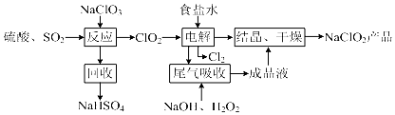
(1)ClO2的沸点为283K,纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下更安全.写出“反应”步骤中生成ClO2的化学方程式 .
(2)“尾气吸收”是吸收“电解”过程排出的少量ClO2 .
①在尾气吸收过程中,可代替H2O2的试剂是(填序号).
A.Na2O2B.Na2S C.FeCl2D.KMnO4
②提高尾气的吸收效率的可行措施有(填序号).
A.尾气吸收时充分搅拌吸收液B.适当加快尾气的通入速率C.将温度控制在20℃以下D.加水稀释尾气吸收液
③此吸收反应中,氧化剂与还原剂的物质的量之比为 .
(3)在碱性溶液中NaClO2比较稳定,在酸性溶液中,ClO2﹣和H+合为HClO2 , HClO2
是唯一的亚卤酸,不稳定,易分解产生Cl2、ClO2和H2O,写出HClO2分解的化学方程式: .
(4)已知NaClO2的溶解度随温度升高而增大,NaClO2饱和溶液在38℃以上60℃以下会析出NaClO2 , 在NaClO2析出过程中可能混有的杂质是(填化学式).
【答案】
(1)2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2
(2)C;AC;2:1
(3)8HClO2=Cl2↑+6ClO2↑+4H2O
(4)NaCl、Na2SO4
【解析】解:(1)NaClO3和SO2在H2SO4酸化条件下生成ClO2 , 其中NaClO2是氧化剂,还原产物为NaCl,回收产物为NaHSO4 , 说明生成硫酸氢钠,且产生ClO2 , 根据电子守恒可知,此反应的化学方程式为:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2 ,
所以答案是:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2;(2)①在尾气吸收过程中,过氧化氢的氢氧化钠溶液吸收ClO2 , 产物为ClO2﹣ , 则H2O2为还原剂,又不能引入新的杂质,所以可代替H2O2的试剂是Na2O2 , 故选:A;
②提高尾气的吸收效率,则可以搅拌、减慢尾气的通入速率、增大吸收液浓度,又ClO2的沸点为283K,所以将温度控制在20℃以下也可以提高尾气的吸收效率,故选:AC;
③由图可知,利用含过氧化氢的氢氧化钠溶液吸收ClO2 , 产物为ClO2﹣ , 则此反应中ClO2为氧化剂,还原产物为ClO2﹣ , 化合价从+4价降为+3价,H2O2为还原剂,氧化产物为O2 , 每摩尔H2O2得到2mol电子,依据电子守恒可知氧化剂和还原剂的物质的量之比为2:1,
所以答案是:2:1;(3)HClO2不稳定,易分解产生Cl2、ClO2和H2O,根据电子守恒可知,分解的化学方程式为8HClO2=Cl2↑+6ClO2↑+4H2O,所以答案是:8HClO2=Cl2↑+6ClO2↑+4H2O;(4)由制备流程可知,进入电解池中为ClO2和多余SO2气体,所以利用含过氧化氢的氢氧化钠溶液吸收尾气ClO2和多余SO2气体,产物为ClO2﹣ , 还会生成Na2SO4 , 所以最后结晶、干燥的溶液除了含NaClO2还含有NaCl、Na2SO4 , 又NaCl、Na2SO4 的溶解度随温度升高而增大,则在38℃以上60℃以下会析出NaClO2时可能混有的杂质是NaCl、Na2SO4 , 所以答案是:NaCl、Na2SO4 .