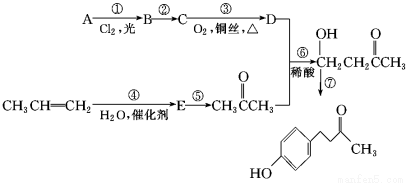
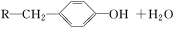
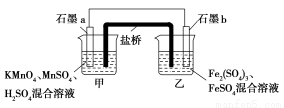
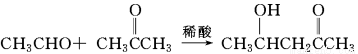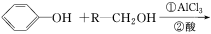题目内容
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:
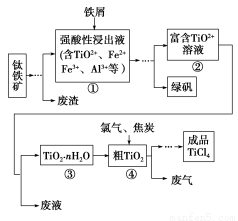
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
Fe+2Fe3+=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
| TiCl4 | SiCl4 |
熔点/℃ | -25.0 | -68.6 |
沸点/℃ | 136.4 | 57.6 |
(1)使Fe3+还原为Fe2+;生成Ti3+保护Fe2+不被氧化
(2)10-9~10-7 m(或其他合理答案)
(3)2.79×103
(4)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(l)+2CO(g) ΔH=-81 kJ·mol-1
(5)产生三废(或其他合理答案)
(6)蒸馏(或分馏或精馏)
【解析】解答本题时应注意以下三点:
(1)求平衡常数时,可以将表达式中的分子和分母都乘以某种微粒的浓度,以找出与所给条件相符的式子。
(2)绿色化学的基本要求:节省原料,无污染。
(3)分离互溶的液体混合物常用蒸馏的方法。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟内不变色。
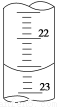
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |