题目内容
请完成下列填空:
(1)当SO2和SO3中分子个数比为1:1 时,原子总数之比为______,质量之比为______.
(2)将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是______.
(3)中和含0.2molHCl的稀盐酸,需NaOH的物质的量为______;如改用KOH,则所需KOH的质量为______.
解:(1)1个SO2分子中含有3个原子,1个SO3分子中含有4个原子,当SO2和SO3中分子个数比为1:1 时,原子总数之比为3:4,根据n=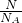 =
= 可知,分子数相同时,物质的量相同,则质量与摩尔质量呈之比,即质量之比为:64:80=4:5,故答案为:3:4;4:5;
可知,分子数相同时,物质的量相同,则质量与摩尔质量呈之比,即质量之比为:64:80=4:5,故答案为:3:4;4:5;
(2)5mol/L的Mg(NO3)2溶液中:c(NO3-)=2c(Mg(NO3)2)=10mol/L,
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,
则有10mol/L×a×10-3L=c×b×10-3L,
稀释后溶液中NO3-的物质的量浓度是c=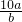 mol/L,
mol/L,
故答案为: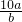 mol/L;
mol/L;
(3)由反应H++OH-=H2O可知,
n(NaOH)=n(HCl)=0.2mol,
n(KOH)=n(HCl)=0.2mol,
m(KOH)=0.2mol×56g/mol=11.2g,
故答案为:0.2mol;11.2g.
分析:(1)根据n=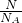 =
= 结合分子组成计算;
结合分子组成计算;
(2)溶液稀释前后溶质的物质的量不变;
(3)根据反应H++OH-=H2O计算.
点评:本题考查物质的量的计算,题目难度不大,注意相关计算公式的运用.
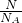 =
= 可知,分子数相同时,物质的量相同,则质量与摩尔质量呈之比,即质量之比为:64:80=4:5,故答案为:3:4;4:5;
可知,分子数相同时,物质的量相同,则质量与摩尔质量呈之比,即质量之比为:64:80=4:5,故答案为:3:4;4:5;(2)5mol/L的Mg(NO3)2溶液中:c(NO3-)=2c(Mg(NO3)2)=10mol/L,
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,
则有10mol/L×a×10-3L=c×b×10-3L,
稀释后溶液中NO3-的物质的量浓度是c=
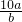 mol/L,
mol/L,故答案为:
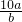 mol/L;
mol/L;(3)由反应H++OH-=H2O可知,
n(NaOH)=n(HCl)=0.2mol,
n(KOH)=n(HCl)=0.2mol,
m(KOH)=0.2mol×56g/mol=11.2g,
故答案为:0.2mol;11.2g.
分析:(1)根据n=
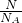 =
= 结合分子组成计算;
结合分子组成计算;(2)溶液稀释前后溶质的物质的量不变;
(3)根据反应H++OH-=H2O计算.
点评:本题考查物质的量的计算,题目难度不大,注意相关计算公式的运用.

练习册系列答案
相关题目

 2NH3
2NH3