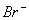题目内容
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
 A、若
A、若 为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
B、若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
C、若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
D、若四种元素中只有一种为金属,则Z与Y两者的最高价氧化物对应的水化物能反应
【知识点】元素周期表与元素周期律的应用
【答案解析】B 解析:由短周期主族元素在周期表中的位置可知,X、Y处于第二周期,Z、W处于第三周期,
A、若HmXOn为强酸,则X只能为N元素,其氢化物氨气溶于水呈碱性,故A错误;B、若四种元素均为金属,则X为Li、Y为Be、Z为Na、W为Mg,Z的最高价氧化物对应的水化物为NaOH为强碱,故B正确;C、若四种元素均为非金属,则X、Z的族序数≥4,而小于7,若处于ⅣA元素,则W为P元素,对应的磷酸不是强酸,故C错误;D、若四种元素中只有一种为金属,则Z为Al、X为B、Y为C、W为Si,氢氧化铝是两性氢氧化物,溶于强酸、强碱,而硅酸属于弱酸,不能与氢氧化铝反应,故D错误。
故答案选B

练习册系列答案
相关题目
 (3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为  (保留两位有效数字)。(
(保留两位有效数字)。( )
)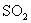 通入溴水中
通入溴水中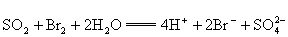
 反应
反应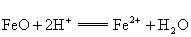
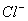 、
、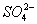 、Fe3+
、Fe3+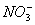 、
、