题目内容
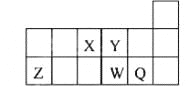
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂 1mol N﹣N键吸收193kJ热量,断裂 1mol N≡N键吸收941kJ热量,则下列说法不正确的是( )
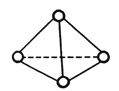
A.N4与N2互为同素异形体
B.1 mol N4气体转化为N2时要放出724 kJ能量
C.N4变成N2是化学变化
D.N4不可能是分子晶体
【答案】D
【解析】
A.N4与N2是同一元素形成的不同性质的单质,二者互为同素异形体,正确;
B.从结构图中可看出,一个N4分子中含有6个N-N键,根据N4(g)=2N2(g)△H,有△H=6×193 kJmol-1-2×941 kJmol-1=-724 kJmol-1,正确;
C.N4与N2是不同的物质,因此N4变为N2的反应是化学变化,正确;
D.N4是由四个N原子形成的分子,形成的就是分子晶体,错误。

 阅读快车系列答案
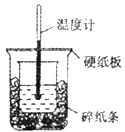
阅读快车系列答案【题目】用如图所示的装置进行中和热的测定实验,分别取50 mL 0.55 mol/L的NaOH溶液、50 mL 0.25 mol/L的硫酸进行实验,回答下列问题:
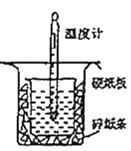
(1)从图中实验装置看,其中尚缺少的用品是_______,除此之外,装置中的一个明显错误是_______。
(2)近似认为0.55 mol/L的NaOH溶液和0.25 mol/L的硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),通过以下数据计算中和热△H=_________。(结果保留小数点后一位)。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 29.5 |
2 | 27.0 | 27.4 | 27.2 | 32.3 |
3 | 25.9 | 25.9 | 25.9 | 29.2 |
4 | 26.4 | 26.2 | 26.3 | 29.8 |
(3)若改用50 mL0.25 mol/L的H2SO4和50 mL0.55 mol/L的NH2·H2O溶液进行反应,与上述实验相比,所放出的热量_______(填“不变”“偏高"或“偏低”)。
(4)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是________(填字母)。
a. 实验装置保温、隔热效果差
b. 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d. 将以上四实验测量温度均纳入计算平均值