��Ŀ����
����Ŀ��ij��ѧС������������ʵ��̽��������Ũ���ᷴӦ���Իش��������⡣
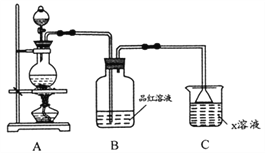
(1)������ͼװ���о�ͭ��Ũ���ᷴӦ,��Ӧ��ѧ����ʽΪ_________;Bװ�õ�Ŀ����______;x��ҺΪ___________��
(2)������ʵ���е�ͭ��Ϊ��ͭ(ͭп�Ͻ�),ʵ���οɹ۲쵽����©����Ե������ð��,��Խ��Խ�졣���������Ϊ____���������Խ��Խ���ԭ�������_____(��������)����֤�������ʵ�鷽������:
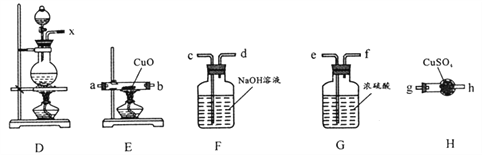
��װ������˳��:x��_________��
����֤���������������ʵ��������__________��
(3)ȡ����þ�ۼ���ʢŨ������ձ�,��ͨ�����ʵ�顣��ַ�Ӧ����Һ���лҰ�ɫ������,��Ʒ����о�������������,��������ơ�(����þ�Ļ����ﶼ����ϡ��)
![]() _____
_____
д�������ûҰ�ɫ��������Ҫ��Ӧ�Ļ�ѧ����ʽ_____��
���𰸡� Cu+2H2SO4(Ũ) ![]() CuSO4+SO2��+2H2O �������SO2 NaOH��Һ(���������𰸾��ɵ÷�) H2 ��Ӧ���ڣ�c(H+)����,��Zn��Ӧ����H2���ʼӿ�;��ͭΪͭп�Ͻ��������γ�ԭ��ز���H2���ʼӿ�;��Ӧ���� c��d��e��f��a��b��g E��(Ӳ�ʲ�����)��ɫ��ĩ��죬H��(���θ����)�����ɰ�ɫ��Ϊ��ɫ
CuSO4+SO2��+2H2O �������SO2 NaOH��Һ(���������𰸾��ɵ÷�) H2 ��Ӧ���ڣ�c(H+)����,��Zn��Ӧ����H2���ʼӿ�;��ͭΪͭп�Ͻ��������γ�ԭ��ز���H2���ʼӿ�;��Ӧ���� c��d��e��f��a��b��g E��(Ӳ�ʲ�����)��ɫ��ĩ��죬H��(���θ����)�����ɰ�ɫ��Ϊ��ɫ ![]() 3Mg+4H2SO4(Ũ)==3MgSO4+S+4H2O
3Mg+4H2SO4(Ũ)==3MgSO4+S+4H2O
����������1��Ũ�������ǿ�����ԣ��ڼ�����������Cu��Ӧ����CuSO4��SO2��H2O���ʻ�ѧ����ʽΪ��Cu+2H2SO4(Ũ)![]() CuSO4+SO2��+2H2O�������������Ư���ԣ�����ʹƷ����Һ��ɫ������Ʒ����Һ����������������壻�����������ж�������Ϊ�������壬CΪβ������װ�ã���x��Һ������NaOH��Һ��
CuSO4+SO2��+2H2O�������������Ư���ԣ�����ʹƷ����Һ��ɫ������Ʒ����Һ����������������壻�����������ж�������Ϊ�������壬CΪβ������װ�ã���x��Һ������NaOH��Һ��
��2����������ʵ���е�ͭ��Ϊ��ͭ(ͭп�Ͻ�)��ʵ����Ũ�����ϡ����п��Ӧ���������������ʵ���οɹ۲쵽����©����Ե������ð������Խ��Խ�죬���������ΪH2������Ӱ�컯ѧ��Ӧ���ʵ����أ���ϸ�ʵ��ԭ�����������������Խ��Խ���ԭ������ǣ���Ӧ���ڣ�Ũ�����Ϊϡ���ᣬ����̶�����c(H+)������Zn��Ӧ����H2���ʼӿ죻��ͭΪͭп�Ͻ��������γ�ԭ��ز���H2���ʼӿ죻��Ӧ���ȵȡ�
����Ҫ��֤�����������������ݿɹ�ѡ���װ�ü�ҩƷ���ȳ�ȥ������������ˮ���Ȼ��ͨ�����ȵ�����ͭ�������������ˮ������װ������˳��:x��c��d��e��f��a��b��g��
����E��(Ӳ�ʲ�����)��ɫ��ĩ��죬˵��������ͭ���ʣ�ͬʱH��(���θ����)�����ɰ�ɫ��Ϊ��ɫ��˵��������ˮ���ɴ˿�֤���������������
��3��þ��Ũ���ᷴӦ��������ܱ������Ժ�ǿ�����ԣ���������������Ǻ���þԪ�ء�SԪ�ص����ʣ��ձ��еĻ�����ˮ�����ܽ⣬���������Ϊ��S���ʣ����˺�ɼ����л��ܼ�(�����̼)�ܽ⣬�ʷ���δ��ɲ��ֿ���Ϊ��![]() �������ûҰ�ɫ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��3Mg+4H2SO4(Ũ)=3MgSO4+S+4H2O��
�������ûҰ�ɫ��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��3Mg+4H2SO4(Ũ)=3MgSO4+S+4H2O��