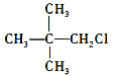
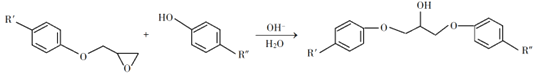
题目内容
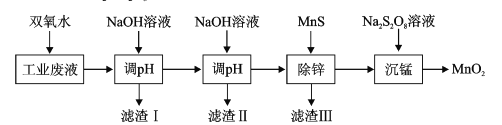
【题目】某科研课题小组研究利用含H+、Zn2+、Mn2+、Fe2+、Fe3+、Cl-、SO42-的工业废液,制备高纯的ZnO、MnO2、Fe2O3,设计出如下实验流程:
已知:
①氢氧化锌沉淀呈白色
②氢氧化锰难溶于水
③溶液中金属离子沉淀完全时,其浓度![]()
回答下列问题:
(1)向工业废液中加入双氧水,可能观察到的现象有:溶液的颜色发生变化和_____,其中引起溶液颜色变化的离子方程式为_____。
(2)第一次调pH的目的是沉淀Fe3+。 检验Fe3+是否完全沉淀的操作:取少量滤液于洁净试管中,最好加入下列试剂中的____ (填标号),并观察实验现象。
a.稀氨水 b.KSCN溶液 c.K3Fe(CN)6溶液
(3)第二次调pH前,科研小组成员在室温下分析此时的溶液,得到相关数据见下表
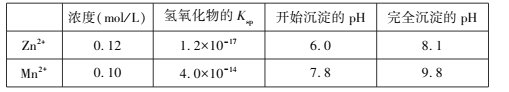
为防止Mn2+也同时沉淀造成产品不纯,最终选择将溶液的pH控制为7.5,则此时溶液中Zn2+ 的沉淀率为____ 。 (第二次调pH前后液体体积的变化忽略不计)
(4)已知常温下,![]() 。在除锌时发生沉淀转化反应为
。在除锌时发生沉淀转化反应为![]() ,其平衡常数K= ___。
,其平衡常数K= ___。
(5)沉锰反应在酸性条件下完成,写出反应的离子方程式____。
(6)下列关于沉锰制备高纯MnO2的说法中,不正确的是____ (填标号)。
a.若沉锰反应时加入足量浓盐酸并加热,MnO2的产率将降低
b.若沉锰后进行过滤操作,为了加快过滤速率,不断用玻璃棒搅拌
c.若除锌时加入MnS质量为xg,沉锰反应中锰元素无损失,MnO2的产量将增加xg
【答案】有无色气体生成 2Fe2++H2O2+2H+=2Fe3++2H2O b 99.9% 2.0×1010 Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+ bc
【解析】
含H+、Zn2+、Mn2+、Fe2+、Fe3+、Cl-、SO42-的工业废电解质溶液,加入双氧水将Fe2+氧化为Fe3+,加入NaOH溶液调节pH沉淀Fe3+得到Fe(OH)3,过滤,向滤液中再次加入NaOH溶液调节pH,将Zn2+沉淀为Zn(OH)2,所以滤渣II主要为Zn(OH)2,向滤液中加入MnS除去剩余锌,过滤掉生成的ZnS,向滤液中加入Na2S2O8,发生反应:Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+,据此分析作答。
(1)向工业废液中加入双氧水,亚铁离子被氧化成铁离子,离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;所以溶液颜色会发生变化,同时溶液中的金属阳离子会催化双氧水的分解生成氧气,所以会观察到有无色气体生成;
(2)检验Fe3+常用KSCN溶液,若有铁离子溶液会变红色,加稀氨水溶液中的Zn2+、Mn2+也会生成沉淀,可能观察不到红褐色沉淀,K3Fe(CN)6溶液可用来检验Fe2+,所以选b;
(3)pH=7.5时,溶液中c(OH-)=10-6.5mol/L,根据Ksp[Zn(OH)2]= c2(OH-)·c(Zn2+)=1.2×10-17可知此时溶液中c(Zn2+)= ,所以此时溶液中Zn2+ 的沉淀率为
,所以此时溶液中Zn2+ 的沉淀率为![]() =99.9%;
=99.9%;
(4)根据反应方程式可知该反应的平衡常数K=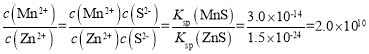 ;
;
(5)沉锰时Na2S2O8将Mn2+氧化成MnO2,自身被还原成SO42-,根据电子守恒和元素守恒可知离子方程式Mn2++S2O82-+2H2O=MnO2↓+2SO42-+4H+;
(6)a.浓盐酸具有还原性,且还原性强于Mn2+,所以先被Na2S2O8氧化,且会与生成的MnO2反应,降低产率,故a正确;
b.玻璃棒搅拌过滤器,易捣碎滤纸,过滤时不能搅拌,故b错误;
c.为保证完全除去锌离子,除锌时加入的MnS要过量,不能完全反应,故c错误;
综上所述选bc。

【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
2SO3(g) △H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol.试回答下列问题:
(1)若平衡时,容器体积为aL,写出该反应的平衡常数为:K=__________(用含a的代数式表示)
(2)反应进行到t1时,SO2的体积分数为_______________;
(3)若在t1时充入一定量的氩气(Ar),SO2的物质的量将________(填“增大”、“减小”或“不变”);
(4)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量____2.1mol(填“<”、“>”或“=”),简单说明原因:____________。
(5)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆________v正 (填“<”、“>”或“=”)。
(6)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 | 2 mol SO2、1 mol O2 |
平衡v正(SO2)/ mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
用“<”、“>”或“=”填入下列横线上:
c2______2c1,v1______v2;K1_____K3,p2____2p3;α1(SO2)_____α3(SO2);α2(SO3)+α3(SO2)_______1