题目内容
某研究性学习小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X.有人认为X不一定只是Fe,因为温度不同、受热不均时会生成Fe3O4,Fe3O4也能被磁铁吸引.,为探究X的组成,进行如下实验.
(一)提出假设①X的成分为Fe
②X的成分为Fe3O4
③X的成分为Fe与Fe3O4的混合物
(二)设计方案
I-定性探究
(1)将适量固体X加入盐酸中,充分反应后,加入适量的KSCN溶液,若溶液未变红色, (填“能”或“不能”)表明固体X中不含Fe304.简述理由
(2)某同学采用还原法检验X中是否含有Fe304.

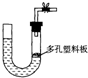
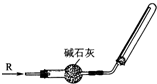
①按如图连接装置,并检查装置的气密性.
②打开止水夹,通入纯净的H2.在点燃A处的酒精灯之前,需排尽装置内的空气,原因是 .
③若加热一段时间后,装置B中的白色固体部分变为蓝色,可得出的结论是
(3)若要进一步证明X的组成,还得进行的实验是(简述实验操作、现象)
结论: .
II.定量探究
某同学利用(2)装置,通过定量实验也可探究X的组成.
①己知a管质量为122.0g,取18.0g干燥X粉末加入a中.
②按(2)进行实验至B中无水硫酸铜颜色不再变化,停止加热,继续通H2至a管恢复室温
③相同条併吓称量,a管质量(含粉末)为138.4g.试通过计算分析X的组成.(要求写出计算过程)
(一)提出假设①X的成分为Fe
②X的成分为Fe3O4
③X的成分为Fe与Fe3O4的混合物
(二)设计方案
I-定性探究
(1)将适量固体X加入盐酸中,充分反应后,加入适量的KSCN溶液,若溶液未变红色,
(2)某同学采用还原法检验X中是否含有Fe304.

①按如图连接装置,并检查装置的气密性.
②打开止水夹,通入纯净的H2.在点燃A处的酒精灯之前,需排尽装置内的空气,原因是
③若加热一段时间后,装置B中的白色固体部分变为蓝色,可得出的结论是
(3)若要进一步证明X的组成,还得进行的实验是(简述实验操作、现象)
结论:
II.定量探究
某同学利用(2)装置,通过定量实验也可探究X的组成.
①己知a管质量为122.0g,取18.0g干燥X粉末加入a中.
②按(2)进行实验至B中无水硫酸铜颜色不再变化,停止加热,继续通H2至a管恢复室温
③相同条併吓称量,a管质量(含粉末)为138.4g.试通过计算分析X的组成.(要求写出计算过程)
分析:(1)根据铁能够与铁离子反应生成亚铁离子分析;
(2)②根据氢气与空气中氧气混合会发生爆炸及氢气与氧气反应生成水干扰实验结果解答;
③根据无水硫酸铜变蓝证明有水生成分析;
(3)利用铁与酸反应时生成氢气检验混合物中是否含有铁;
II.先假设X根据a管中加热前与加热之后的质量差计算出Fe3O4的质量,再根据计算出的质量与18.0g的大小关系判断X的组成.
(2)②根据氢气与空气中氧气混合会发生爆炸及氢气与氧气反应生成水干扰实验结果解答;
③根据无水硫酸铜变蓝证明有水生成分析;
(3)利用铁与酸反应时生成氢气检验混合物中是否含有铁;
II.先假设X根据a管中加热前与加热之后的质量差计算出Fe3O4的质量,再根据计算出的质量与18.0g的大小关系判断X的组成.
解答:解:(1)由于混合物中可能为Fe和Fe3O4的混合物,铁能够与铁离子反应生成亚铁离子,所以将适量固体X加入盐酸中,充分反应后,加入适量的KSCN溶液,若溶液未变红色,不能判断固体X中不含Fe304,
故答案为:不能;在有铁存在下,可使铁离子还原成亚铁离子;
(2)②打开止水夹,通入纯净的H2,在点燃A处的酒精灯之前,防止空气与空气混合加热时发生爆炸,同时也避免氢气与氧气反应生成水而干扰实验,所以需排尽装置内的空气,
故答案为:防止空气与空气混合加热时发生爆炸,同时也避免氢气与氧气反应生成水而干扰实验;
③若加热一段时间后,装置B中的白色固体无水硫酸铜变为蓝色,证明有水生成,所以混合物中含有氧元素,证明固体X中含有Fe3O4,
故答案为:固体X中含有Fe3O4;
(3)若要进一步证明X的组成,还得进行的实验为:取少量X粉末与试管中,滴加稀盐酸,产生气泡(或一直不产生气泡),X为Fe与Fe3O4的混合物(或为Fe3O4),
故答案为:取少量X粉末与试管中,滴加稀盐酸,产生气泡(或一直不产生气泡);X为Fe与Fe3O4的混合物(或为Fe3O4);
II.Fe3O4被含有生成了铁,混合物质量减少,减少的质量为氧元素的质量,所以根据试管加热前后质量差计算出Fe3O4的质量,
Fe3O4 ~4 O
232 64
m(Fe3O4)(122.0+18.0-138.4)g=5.8g
得m(Fe3O4)=
=5.8g,
由于 m(Fe3O4)<18.0g,所以X为Fe和Fe3O4的混合物,
答:X为Fe和Fe3O4的混合物.
故答案为:不能;在有铁存在下,可使铁离子还原成亚铁离子;
(2)②打开止水夹,通入纯净的H2,在点燃A处的酒精灯之前,防止空气与空气混合加热时发生爆炸,同时也避免氢气与氧气反应生成水而干扰实验,所以需排尽装置内的空气,
故答案为:防止空气与空气混合加热时发生爆炸,同时也避免氢气与氧气反应生成水而干扰实验;
③若加热一段时间后,装置B中的白色固体无水硫酸铜变为蓝色,证明有水生成,所以混合物中含有氧元素,证明固体X中含有Fe3O4,
故答案为:固体X中含有Fe3O4;
(3)若要进一步证明X的组成,还得进行的实验为:取少量X粉末与试管中,滴加稀盐酸,产生气泡(或一直不产生气泡),X为Fe与Fe3O4的混合物(或为Fe3O4),
故答案为:取少量X粉末与试管中,滴加稀盐酸,产生气泡(或一直不产生气泡);X为Fe与Fe3O4的混合物(或为Fe3O4);
II.Fe3O4被含有生成了铁,混合物质量减少,减少的质量为氧元素的质量,所以根据试管加热前后质量差计算出Fe3O4的质量,
Fe3O4 ~4 O
232 64
m(Fe3O4)(122.0+18.0-138.4)g=5.8g
得m(Fe3O4)=
| 232×1.6g |
| 64 |
由于 m(Fe3O4)<18.0g,所以X为Fe和Fe3O4的混合物,
答:X为Fe和Fe3O4的混合物.
点评:本题探究物质的组成、测量物质的含量,该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是 ( )
| A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏 | B、如果实验中需用60mL 的稀硫酸标准溶液,配制时应选用100mL容量瓶 | C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小 | D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大 | E、配制溶液时,若在最后一次读数时俯视读数,则导致最后实验结果偏大 | F、中和滴定时,若在最后一次读数时俯视读数,则导致最后实验结果偏大 |