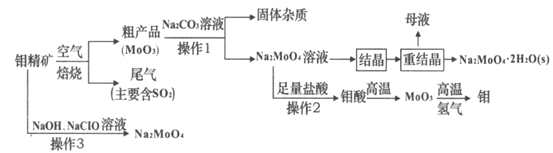
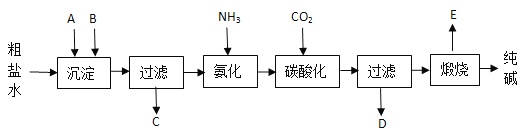
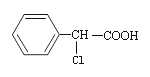
题目内容
【题目】向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如右图,则原混合溶液中MgCl2与FeCl3的物质的量之比为( ) 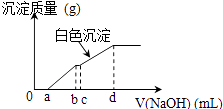
A.![]()
B.![]()
C.![]()
D.![]()
【答案】D
【解析】解:向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,首先发生反应NaOH+HCl=NaCl+H2O,即为图象中0﹣amL,沉淀的质量为0g;FeCl3只能在酸性较强的溶液中存在,当酸性减弱时,会转化为Fe(OH)3沉淀,从amL开始,bmL时沉淀完全.bmL时,溶液仍然呈酸性,到cmL时,才开始产生Mg(OH)2沉淀,
令氢氧化钠浓度为xmol/L,
Fe3+完全沉淀消耗氢氧化钠为(b﹣a)mL,结合Fe3++3OH﹣═Fe(OH)3↓可知,溶液中n(Fe3+)= ![]() ×(b﹣a)×10﹣3Lxmol/L,
×(b﹣a)×10﹣3Lxmol/L,
Mg2+完全沉淀消耗氢氧化钠为(d﹣c)mL,结合Mg2++2OH﹣═Mg(OH)2↓可知,溶液中n(Mg2+)= ![]() ×(d﹣c)×10﹣3Lxmol/L,
×(d﹣c)×10﹣3Lxmol/L,
故原混合溶液中n(MgCl2):n(FeCl3)= ![]() ×(d﹣c)×10﹣3Lxmol/L:
×(d﹣c)×10﹣3Lxmol/L: ![]() ×(b﹣a)×10﹣3Lxmol/L=
×(b﹣a)×10﹣3Lxmol/L= ![]() ,
,
故选D.

【题目】亚硝酸钠(化学式为 NaNO2)是一种常用的防腐剂,回答下列问题:
(1)NaNO2 中 N 元素的化合价为_________.
(2)亚硝酸钠在 320°C 时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。该反应的化学方程式_________________。
(3)我国规定火腿肠中亚硝酸钠添加标准为每千克食品含量不超过 150 毫克,以此计算,200g 15%的亚硝酸钠溶液至少可用于生产火腿肠______千克。
(4)在酸性条件下,NaNO2与按物质的量 1:1 恰好完全反应,且I-被氧化为 I2时,产物中含氮的物质为________(填化学式)。
(5)工业废水中的 NaNO2 可用铝粉除去,已知此体系中包含 AI、NaAlO2、NaNO2、NaOH、NH3、H2O 六种物质。该反应的化学方程式为____________。
(6)某同学设计实验对工业产品中 NaNO2 的含量进行测定,你取固体样品 2g,完全溶解配制成溶液 100mL 取出 25mL 溶液用 0.100 mol/L 酸性 KMnO4 溶液进行滴定(杂质不与 KMnO4 反应),实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.70 | 20.02 | 20.00 | 19.98 |
该样品中亚硝酸钠的质量分数为_________.(已知:5NO2-+2MnO4-+6H+ = 5NO3-+2Mn2++3H2O)