题目内容
【题目】Na2S2O5常用作纺织业棉麻脱氯剂;酸化时可放出SO2气体。其制备工艺流程
如下:
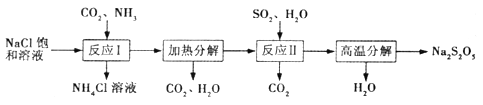
(1)Na2S2O5的名称为_______________(选填“焦硫酸钠”或“焦亚硫酸钠”)。
(2)“反应I ”中应先通入的气体是______,反应后析出的固体产物是____________。
(3)“反应II”的化学方程式为_________________________。
(4)若反应条件或用量等控制不当,则所得的Na2S2O5产品中往往含有杂质。
①若产品中含有杂质Na2SO3,其具体原因可能是______________(任答一条即可);
②若检验产品中含有杂质Na2SO3,下列试剂的使用顺序依次为_________(填编号)。
a.稀硫酸 b.澄淸石灰水 c.品红溶液 d.酸性KMnO4溶液
(5)Na2S2O3也可用作棉麻的脱氯剂。
①Na2S2O5溶液与Cl2反应的离子方程式为____________________;
②Na2S2O5与Na2S2O3脱氯等效时,消耗二者的质量之比为____________。
【答案】 焦亚硫酸钠 NH3(或:氨气) NaHCO3(或:碳酸氢钠) Na2CO3+2SO2+H2O=2NaHSO3+CO2↑ 反应II中SO2的用量不足:NaHSO3分解时反应温度不高 a d c b S2O52-+2Cl2+3H2O==6H++2SO42-+4C1- 190:79(或:2.4:1)
【解析】该原理为:反应Ⅰ为生成NaHCO3,加热生成Na2CO3,在反应Ⅱ中二氧化硫与碳酸钠反应生成NaHSO3与二氧化碳,加热NaHSO3生成Na2S2O5.
(1)S为+4价, Na2S2O5的名称为焦亚硫酸钠;(2)工艺流程可知,反应Ⅰ为生成NaHCO3,氯化钠溶液通入氨气、二氧化碳生成碳酸氢钠与氯化铵,反应方程式为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出;(3) “反应II”的化学方程式为Na2CO3+2SO2+H2O=2NaHSO3+CO2↑ (4)反应Ⅱ中发生反应Na2CO3+H2O+2SO2=2NaHSO3+CO2↑,2NaHSO3![]() Na2S2O5+H2O,故SO2与Na2CO3的物质的量之比接近2:1恰好完全反应,若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低,①若产品中含有杂质Na2SO3,其具体原因可能是:反应II中SO2的用量不足:NaHSO3分解时反应温度不高。②产品中可能含有杂质Na2SO3、Na2CO3,a.加稀硫酸产生SO2、CO2,通入d.酸性KMnO4溶液,除去SO2,再通入 c.品红溶液,确定SO2已除尽,最后再通入 b.澄淸石灰水,检验CO2。故试剂的使用顺序依次为a d c b;(5)①Na2S2O5溶液与Cl2反应的离子方程式为 S2O52-+2Cl2+3H2O==6H++2SO42-+4C1- ,S2O32-+4Cl2+5H2O==10H++2SO42-+8C1- ,由方程式可知,当Cl2相同时,2Na2 S2O5~Na2S2O3,消耗二者的质量之比为190×2:158=190:79(或:2.4:1)
Na2S2O5+H2O,故SO2与Na2CO3的物质的量之比接近2:1恰好完全反应,若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低,①若产品中含有杂质Na2SO3,其具体原因可能是:反应II中SO2的用量不足:NaHSO3分解时反应温度不高。②产品中可能含有杂质Na2SO3、Na2CO3,a.加稀硫酸产生SO2、CO2,通入d.酸性KMnO4溶液,除去SO2,再通入 c.品红溶液,确定SO2已除尽,最后再通入 b.澄淸石灰水,检验CO2。故试剂的使用顺序依次为a d c b;(5)①Na2S2O5溶液与Cl2反应的离子方程式为 S2O52-+2Cl2+3H2O==6H++2SO42-+4C1- ,S2O32-+4Cl2+5H2O==10H++2SO42-+8C1- ,由方程式可知,当Cl2相同时,2Na2 S2O5~Na2S2O3,消耗二者的质量之比为190×2:158=190:79(或:2.4:1)

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案

