题目内容
【题目】下列实验操作、现象与预期实验目的或所得实验结论一致的是

A.AB.BC.CD.D
【答案】A
【解析】
A. 等体积饱和溶液中,溶质溶解度大的反应产生的沉淀多;
B. 银镜反应需在碱性条件下进行;
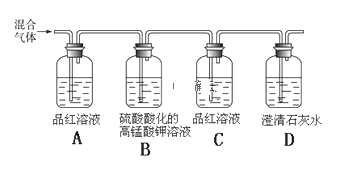
C. SO2水溶液显酸性,溶液中含SO32-浓度很小,根据BaSO4不溶于水,也不溶于酸,而BaSO3不溶于水,但能溶于酸;
D. 先判断物质的过量问题,然后判断反应的可逆性。
A. AgCl、AgBr在溶液中存在沉淀溶解平衡,向等体积AgCl、AgBr饱和溶液中加入足量AgNO3浓溶液,产生沉淀的物质的量AgCl>AgBr,说明溶液中含有AgCl>AgBr,因此可证明物质的溶度积常数Ksp(AgCl)>Ksp(AgBr),A正确;
B. 向20%的蔗糖溶液中加入一定体积稀硫酸,加热,使蔗糖发生水解反应,然后加入NaOH中和硫酸,使溶液显碱性,然后再加入银氨溶液,水浴加热,才可以发生银镜反应,否则不能证明蔗糖是否发生水解反应,B错误;
C. 向BaCl2溶液中通入SO2气体和气体X,产生白色沉淀,该气体可能是碱性气体NH3,反应产生的白色沉淀是BaSO3;也可能是具有氧化性的气体如Cl2,反应产生的是BaSO4白色沉淀,C错误;
D. FeCl3与KI会发生反应:2FeCl3+2KI=2FeCl2+I2+2KCl,n(FeCl3)=5×10-4 mol>n(KI)=1×10-4 mol,FeCl3溶液过量,所以取反应后上层清液滴加KSCN溶液,溶液变为红色,不能证明该反应为可逆反应,D错误;
故合理选项是A。

练习册系列答案
相关题目