题目内容
 (2013?临沭县模拟)在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI?H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是( )
(2013?临沭县模拟)在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HI?H2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是( )分析:A.由图可知,平衡时生成氢气为0.1mol,根据方程式计算生成的n(I2)、参加反应的n(HI),进而计算平衡时HI的物质的量,由于反应前后气体的化学计量数相等,利用物质的量代替浓度代入平衡常数表达式计算;
B.由图可知,2min内生成氢气为0.1mol,根据v=
计算v(H2),再根据速率之比等于化学计量数之比计算v(HI);
C.恒压下向该体系中加入N2,体积增大,反应混合物的浓度减小,反应速率减小,等效为降低压强,结合化学计量数判断平衡移动;
D.升高温度正、逆反应速率都增大.
B.由图可知,2min内生成氢气为0.1mol,根据v=
| ||
| △t |
C.恒压下向该体系中加入N2,体积增大,反应混合物的浓度减小,反应速率减小,等效为降低压强,结合化学计量数判断平衡移动;
D.升高温度正、逆反应速率都增大.
解答:解:A.由图可知,平衡时生成氢气为0.1mol,根据方程式计算生成的n(I2)=n(H2)=0.1mol,参加反应的n(HI)=2n(H2)=0.2mol,平衡时HI的物质的量为1mol-0.2mol=0.8mol,由于反应前后气体的化学计量数相等,利用物质的量代替浓度计算平衡常数,故平衡常数k=
=
,故A错误;
B.由图可知,2min内生成氢气为0.1mol,故v(H2)=
=0.025mol?L-1?min-1,速率之比等于化学计量数之比,故v(HI)=2v(H2)=0.05mol?L-1?min-1,故B正确;
C.恒压下向该体系中加入N2,体积增大,等效为降低压强,该反应前后气体的体积不变,平衡不移动.反应混合物的浓度减小,反应速率减小,故C错误;
D.升高温度正、逆反应速率都增大,正反应速率增大更多,平衡向正反应方向移动,故D错误;
故选B.
| 0.1×0.1 |
| 0.82 |
| 1 |
| 64 |
B.由图可知,2min内生成氢气为0.1mol,故v(H2)=
| ||
| 2min |
C.恒压下向该体系中加入N2,体积增大,等效为降低压强,该反应前后气体的体积不变,平衡不移动.反应混合物的浓度减小,反应速率减小,故C错误;
D.升高温度正、逆反应速率都增大,正反应速率增大更多,平衡向正反应方向移动,故D错误;
故选B.
点评:本题考查化学平衡图象、影响化学平衡因素、化学反应速率计算及影响因素等,难度中等,C选项注意根据浓度变化理解压强的影响.

练习册系列答案
相关题目
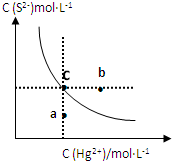 (2013?临沭县模拟)硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2013?临沭县模拟)硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥等.某温度时,HgS在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
 (R、R′可以是烃基或H原子)
(R、R′可以是烃基或H原子)

