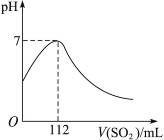
题目内容
24mLH2S在30mLO2中燃烧,在同温同压下,得到SO2的体积为( )
| A.24mL | B.30mL | C.20mL | D.18mL |
D
H2S燃烧的化学方程式:
2H2S+O2(不足) 2S↓+2H2O ①
2S↓+2H2O ①
当O2过量时,继续发生化学反应
S+O2 SO2 ②
SO2 ②
合并得
2H2S+3O2 2SO2+2H2O③
2SO2+2H2O③
则当V(H2S)∶V(O2)≥2∶1时,只按①式进行。
当V(H2S)∶V(O2)≤2∶3时,只按③式进行。
当2∶3<V(H2S)∶V(O2)<2∶1时,可按①式和②式进行(如按①式和③式进行)。
解法一:2H2S+O2 2S↓+2H2O①
2S↓+2H2O①
2H2S+3O2 2SO2+2H2O②
2SO2+2H2O②
从①式考虑:2H2S ~ O2 ~ 2S
24mL 30mL
可知余O2为:30mL-12mL=18mL
余O2会继续与S反应生成SO2,由此可确定生成SO2的体积:
O2 ~ SO2
18mL 18mL
答案为D。
从②式考虑:2H2S ~ 3O2 ~ 2SO2
20mL 30mL 20mL
余H2S的体积:24mL-20mL=4mL
因2H2S+SO2 2H2O+3S↓
2H2O+3S↓
4mLH2S将消耗2mLSO2,剩余SO2为20mL-2mL=18mL。
解法二:H2S在O2中燃烧,按H2S与O2的体积比(或物质的量之比)不同,可发生不同的反应。
当V(H2S)∶V(O2)≥2∶1时:只发生2H2S+O2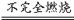 2S↓+2H2O
2S↓+2H2O
当V(H2S)∶V(O2)≤2∶3时:只发生2H2S+3O2 2SO2+2H2O
2SO2+2H2O
现V(H2S)∶V(O2)=24∶30=4∶5,介于2∶1~2∶3之间,所以两个反应均发生。
设不完全燃烧H2S的体积为x,完全燃烧H2S的体积为y,则
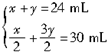 解得
解得 
由化学方程式知:生成SO2的体积等于完全燃烧的H2S的体积,即为18mL。
解法三:本题H2S与O2的体积之比为2∶1>V(H2S)∶V(O2)>2∶3,说明两种燃烧方式均存在,可根据题给H2S与O2的体积(或物质的量)之比写出总的反应方程式:
xH2S+yO2 xH2O+
xH2O+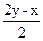 SO2+
SO2+ S
S
将x=24mL、y=30mL代入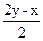 ,
, =18mL。
=18mL。
2H2S+O2(不足)
 2S↓+2H2O ①
2S↓+2H2O ①当O2过量时,继续发生化学反应
S+O2
 SO2 ②
SO2 ②合并得
2H2S+3O2
 2SO2+2H2O③
2SO2+2H2O③则当V(H2S)∶V(O2)≥2∶1时,只按①式进行。
当V(H2S)∶V(O2)≤2∶3时,只按③式进行。
当2∶3<V(H2S)∶V(O2)<2∶1时,可按①式和②式进行(如按①式和③式进行)。
解法一:2H2S+O2
 2S↓+2H2O①
2S↓+2H2O①2H2S+3O2
 2SO2+2H2O②
2SO2+2H2O②从①式考虑:2H2S ~ O2 ~ 2S
24mL 30mL
可知余O2为:30mL-12mL=18mL
余O2会继续与S反应生成SO2,由此可确定生成SO2的体积:
O2 ~ SO2
18mL 18mL
答案为D。
从②式考虑:2H2S ~ 3O2 ~ 2SO2
20mL 30mL 20mL
余H2S的体积:24mL-20mL=4mL
因2H2S+SO2
 2H2O+3S↓
2H2O+3S↓4mLH2S将消耗2mLSO2,剩余SO2为20mL-2mL=18mL。
解法二:H2S在O2中燃烧,按H2S与O2的体积比(或物质的量之比)不同,可发生不同的反应。
当V(H2S)∶V(O2)≥2∶1时:只发生2H2S+O2
 2S↓+2H2O
2S↓+2H2O当V(H2S)∶V(O2)≤2∶3时:只发生2H2S+3O2
 2SO2+2H2O
2SO2+2H2O现V(H2S)∶V(O2)=24∶30=4∶5,介于2∶1~2∶3之间,所以两个反应均发生。
设不完全燃烧H2S的体积为x,完全燃烧H2S的体积为y,则
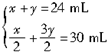 解得
解得 
由化学方程式知:生成SO2的体积等于完全燃烧的H2S的体积,即为18mL。
解法三:本题H2S与O2的体积之比为2∶1>V(H2S)∶V(O2)>2∶3,说明两种燃烧方式均存在,可根据题给H2S与O2的体积(或物质的量)之比写出总的反应方程式:
xH2S+yO2
 xH2O+
xH2O+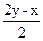 SO2+
SO2+ S
S将x=24mL、y=30mL代入
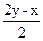 ,
, =18mL。
=18mL。
练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目