题目内容
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
A.根据表中数据不能计算出混合物中NaHCO3的
B.加入混合物9.2 g时盐酸过量
C.盐酸的物质的量浓度为3.0 mol?L-1
D.15.7 g混合物恰好与盐酸完全反应
【答案】分析:由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足;
由反应H++HCO3-=CO2↑+H2O知,盐酸的物质的量为:n(HCl)=n(CO2)=0.15 mol,
设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为x和y,
则有:x+y=0.1mol ①
84x+100y=9.2g ②
解得:x=0.05 mol,?y=0.05 mol
所以c(HCl)=0.15 mol/0.05 L=3 mol/L,
w(NaHCO3)=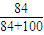 ×100%=45.65%
×100%=45.65%
又由n(NaHCO3)=n(KHCO3),84?n(NaHCO3)+100?n(KHCO3)=15.7g,
解得n (NaHCO3)=0.085 mol,所以15.7 g混合物完全反应消耗HCl的物质的0.17 mol>0.15 mol,故不能恰好完全反应.
解答:解:A.第一组实验盐酸过量,固体完全反应,两成分中所含碳酸氢根的物质的量n(HCO3-)等于二氧化碳的物质的量,则84n(NaHCO3)+100[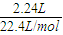 -n(NaHCO3)]=9.2 g,解得:n(NaHCO3)=0.05 mol,能计算NaHCO3的质量分数,故A错误;
-n(NaHCO3)]=9.2 g,解得:n(NaHCO3)=0.05 mol,能计算NaHCO3的质量分数,故A错误;
B.由于第二组实验所得气体多于第一组实验,且盐酸同量,说明加入混合物9.2 g时盐酸过量,故B正确;
C.由表知,最后一栏为盐酸不足,可根据生成气体的物质的量计算盐酸的浓度,c(HCl)=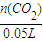 =
=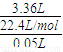 =3.0mol/L,故C正确;
=3.0mol/L,故C正确;
D.由分析可知n(NaHCO3)=n(KHCO3),84?n(NaHCO3)+100?n(KHCO3)=15.7g,解得n (NaHCO3)=0.085 mol,所以15.7 g混合物完全反应消耗HCl的物质的0.17 mol>0.15 mol,故不能恰好完全反应;或从前两组中的数据可以看出,二氧化碳的体积增加了 ,混合物的质量也需要增加
,混合物的质量也需要增加 ,第二组中实际参加反应的混合物是9.2g+
,第二组中实际参加反应的混合物是9.2g+ ×9.2g=13.8克,15.7克的混合物过量,故D错误;
×9.2g=13.8克,15.7克的混合物过量,故D错误;
故选AD.
点评:本题考查化合物的计算,侧重于学生数据分析能力和计算能力的考查,题目难度较大,本题注意比较三组数据,判断反应的程度,为解答该题的关键点,也是易错点,答题时注意体会.
由反应H++HCO3-=CO2↑+H2O知,盐酸的物质的量为:n(HCl)=n(CO2)=0.15 mol,
设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为x和y,
则有:x+y=0.1mol ①
84x+100y=9.2g ②
解得:x=0.05 mol,?y=0.05 mol
所以c(HCl)=0.15 mol/0.05 L=3 mol/L,
w(NaHCO3)=
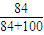 ×100%=45.65%
×100%=45.65%又由n(NaHCO3)=n(KHCO3),84?n(NaHCO3)+100?n(KHCO3)=15.7g,
解得n (NaHCO3)=0.085 mol,所以15.7 g混合物完全反应消耗HCl的物质的0.17 mol>0.15 mol,故不能恰好完全反应.
解答:解:A.第一组实验盐酸过量,固体完全反应,两成分中所含碳酸氢根的物质的量n(HCO3-)等于二氧化碳的物质的量,则84n(NaHCO3)+100[
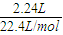 -n(NaHCO3)]=9.2 g,解得:n(NaHCO3)=0.05 mol,能计算NaHCO3的质量分数,故A错误;
-n(NaHCO3)]=9.2 g,解得:n(NaHCO3)=0.05 mol,能计算NaHCO3的质量分数,故A错误;B.由于第二组实验所得气体多于第一组实验,且盐酸同量,说明加入混合物9.2 g时盐酸过量,故B正确;
C.由表知,最后一栏为盐酸不足,可根据生成气体的物质的量计算盐酸的浓度,c(HCl)=
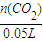 =
=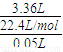 =3.0mol/L,故C正确;
=3.0mol/L,故C正确;D.由分析可知n(NaHCO3)=n(KHCO3),84?n(NaHCO3)+100?n(KHCO3)=15.7g,解得n (NaHCO3)=0.085 mol,所以15.7 g混合物完全反应消耗HCl的物质的0.17 mol>0.15 mol,故不能恰好完全反应;或从前两组中的数据可以看出,二氧化碳的体积增加了
 ,混合物的质量也需要增加
,混合物的质量也需要增加 ,第二组中实际参加反应的混合物是9.2g+
,第二组中实际参加反应的混合物是9.2g+ ×9.2g=13.8克,15.7克的混合物过量,故D错误;
×9.2g=13.8克,15.7克的混合物过量,故D错误;故选AD.
点评:本题考查化合物的计算,侧重于学生数据分析能力和计算能力的考查,题目难度较大,本题注意比较三组数据,判断反应的程度,为解答该题的关键点,也是易错点,答题时注意体会.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
| 某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理不正确的是 ( )
|
(2011?上海模拟)某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
|
某学生用NaHCO3和KHCO3组成的混合物样品与某种浓度的盐酸反应进行实验,测得数据如下表:
分析表中数据,下列说法中不正确的是( )
| 实验编号 | ① | ② | ③ |
| 盐酸体积/mL | 50 | 50 | 50 |
| M(混合物)/g | 9.2 | 26.56 | 36.8 |
| V(CO2)(标准状况)/L | 2.24 | 4.48 | 4.48 |
| A、由①、②可知:①中的盐酸过量 |
| B、由②、③可知:混合物的质量增加,而气体体积没有变化,说明盐酸已经反应完全 |
| C、所用盐酸的物质的量浓度为0.4 mol?L-1 |
| D、该混合物中NaHCO3的物质的量分数为50% |
某学生用NaHCO3和KHCO3组成的某固体混合物进行实验,测得如下表数据(盐酸的物质的量浓度相等):
分析表中数据,下列说法不正确的是( )
| 实验编号 | ① | ② | ③ |
| 盐酸体积 | 50mL盐酸 | 50mL盐酸 | 50mL盐酸 |
| m(混合物) | 9.2g | 16.56g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A、由①可以计算出盐酸的物质的量浓度 |
| B、由②、③可知:混合物质量增加,气体体积没有变化,说明盐酸已经反应完全 |
| C、由①、②可知:①中的固体不足而完全反应 |
| D、由①可以计算出混合物的NaHCO3的质量分数 |
某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)
下列分析推理中不正确的是( )
| 50mL盐酸 | 50mL盐酸 | 50mL | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A、盐酸的物质的量浓度为3.0mol?L-1 |
| B、加入混合物9.2g时盐酸过量 |
| C、根据表中数据不能计算出混合物中NaHCO3的质量分数 |
| D、该混合物中NaHCO3和KHCO3的物质的量之比为1:1 |