题目内容
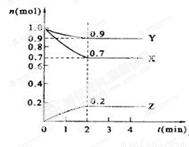
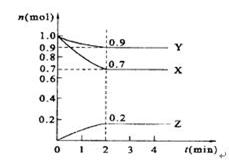
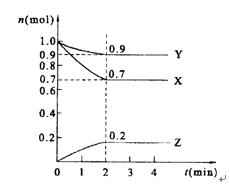
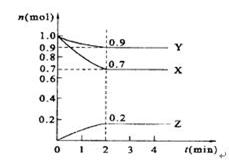
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。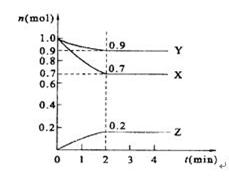
(1)X的转化率是 ;
(2)由图中所给数据进行分析,该反应的化学方程式为 ;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= ;
(4)当反应进行到第 min,该反应是达到平衡。
(8分) (1)30% (2)3X+Y 2Z (3)0.05mol/(L.min) (4)2
2Z (3)0.05mol/(L.min) (4)2
解析试题分析:(1)根据图像可知,平衡时X的物质的量是0.7mol,即消耗X的物质的量是1.0mol-0.7mol=0.3mol,则X的转化率是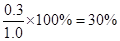 。
。
(2)反应进行到2min是各种物质的物质的量浓度不再发生变化,此时Y的物质的量减少了1.0mol-0.9mol=0.1mol。Z的物质的量增加了0.2mol,所以该反应的方程式是3X+Y 2Z。
2Z。
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)= =0.05mol/(L·min)。
=0.05mol/(L·min)。
(4)当反应进行到第2min,该反应是达到平衡。
考点:考查可逆反应限度的判断、图像识别以及反应速率和转化率的有关计算
点评:该题是基础性试题的考查,试题难易适中,侧重对学生基础知识的巩固与训练,主要是考查学生对可逆反应限度的熟悉程度,以及灵活运用基础知识解决实际问题的能力。该题的关键是记住可逆反应的限度和反应速率的含义和表达式,然后结合图像灵活运用即可。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
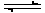 2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)= ; (2)2s时的O2浓度 。
2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)= ; (2)2s时的O2浓度 。