题目内容
【题目】氮氧化物的存在会破坏地球环境,人们一直在积极探索改善大气质量的有效措施。已知:N2(g)+O2(g)![]() 2NO(g) △H=+181.5 kJ·mol-1
2NO(g) △H=+181.5 kJ·mol-1
(1)写出NO2转化为HNO3的化学方程式______。
(2)氮氧化物是形成臭氧层空洞、光化学烟雾、______(列举一种)等大气污染现象的物质之一。北京市为防治大气污染,采取的措施有______(写两点即可)。
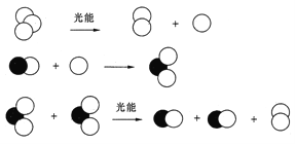
(3)NOx在平流层使O3浓度减少,形成臭氧层空洞,其中一种反应机理可用下图表示,写出其总反应的化学方程式______。
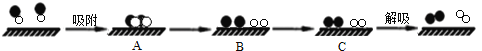
(4)某科研小组尝试利用固体表面催化工艺进行NO的分解。若用![]() 、
、![]() 、
、![]() 和
和![]() 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是______(填字母序号)。
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是______(填字母序号)。
(5)温度为T1时,在容积为1L的恒容密闭容器中充入0.6mol的NO2,达平衡时c(O2)=0.2mol/L,仅发生反应:2NO2(g)![]() 2NO(g)+O2 (g)(△H>0)。实验测得:v正=v (NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO) c(O2),k正、k逆为速率常数,仅受温度影响。当温度改变为T2时,若k正=k逆,则T1______T2(填“>”或“<”),得出该结论的理由是______。
2NO(g)+O2 (g)(△H>0)。实验测得:v正=v (NO2)消耗=k正c2(NO2),v逆=v(NO)消耗=2v(O2)消耗=k逆c2(NO) c(O2),k正、k逆为速率常数,仅受温度影响。当温度改变为T2时,若k正=k逆,则T1______T2(填“>”或“<”),得出该结论的理由是______。
【答案】3NO2+H2O= 2HNO3+NO 雾霾、酸雨、温室效应等 新能源汽车;汽车限行;推广使用清洁燃料;煤改电等 2O3![]() 3O2 C T2>T1 达到平衡状态时正逆反应速率相等,根据k正c2(NO2)=k逆c2(NO)c(O2),且k正=k逆,可知c2(NO2)=c2(NO)c(O2),T2时化学平衡常数K等于1,大于0.8,且该反应的正反应是吸热反应,说明升高温度平衡正向移动,所以 T2>T1
3O2 C T2>T1 达到平衡状态时正逆反应速率相等,根据k正c2(NO2)=k逆c2(NO)c(O2),且k正=k逆,可知c2(NO2)=c2(NO)c(O2),T2时化学平衡常数K等于1,大于0.8,且该反应的正反应是吸热反应,说明升高温度平衡正向移动,所以 T2>T1
【解析】
(1)NO2与水反应生成HNO3和NO;
(2)使用新能源汽车替代使用汽油和柴油的汽车、推行汽车限行组成、推广使用清洁燃料、煤改电等措施减少氮氧化物的排放,减少臭氧层空洞、光化学烟雾、雾霾、酸雨、温室效应等大气污染现象的产生;
(3)由反应机理可知,臭氧在一氧化氮作催化剂时分解生成氧气,破坏臭氧层;
(4)破坏化学键需要吸收能量,形成化学键需要放出能量,能量越高越不稳定,越低越稳定;
(5)升高温度平衡向吸热方向移动。
(1)NO2与水反应生成HNO3和NO,反应的化学方程式为:3NO2+H2O= 2HNO3+NO,故答案为:3NO2+H2O= 2HNO3+NO;
(2)氮氧化物是形成臭氧层空洞、光化学烟雾、雾霾、酸雨、温室效应等大气污染现象的主要原因之一,为减少氮氧化物的排放,减少大气污染,应降低化石能源的使用,可以采用的措施有使用新能源汽车替代使用汽油和柴油的汽车、推行汽车限行组成、推广使用清洁燃料、煤改电等,故答案为:雾霾、酸雨、温室效应等;新能源汽车、汽车限行、推广使用清洁燃料、煤改电等;
(3)反应机理可知,臭氧在光的作用下分解生成氧气和氧原子,氧原子与一氧化氮反应生成二氧化氮,二氧化氮分子间反应生成一氧化氮和氧气,总反应方程式为:2O3![]() 3O2,故答案为:2O3
3O2,故答案为:2O3![]() 3O2;
3O2;
(4)从机理图可以看出,首先A状态中,NO被吸附到催化剂表面,B状态为NO变成N原子和O原子,这个过程需要吸收能量,C状态为N原子和N原子结合变成N2,O原子和O原子结合变成O2,这个过程为成键过程,需要放出能量,体系能量降低,故答案为:C;
(5)由题给数据可知,温度为T1时,c(NO2)=(0.6mol/L—0.4mol/L )、c(NO)=0.4mol/L、c(O2)= 0.2mol/L,化学平衡常数K为(0.4mol/L)2×(0.2mol/L)/(0.2mol/L)2=0.8;达到平衡状态时正逆反应速率相等,根据k正c2(NO2)=k逆c2(NO)c(O2),达到平衡状态时正逆反应速率相等,根据k正c2(NO2)=k逆K,若k正=k逆,=1>0.8,由于该反应的正反应是吸热反应,说明升高温度平衡正向移动,所以 T2>T1,故答案为:>;达到平衡状态时正逆反应速率相等,根据k正c2(NO2)=k逆c2(NO)c(O2),且k正=k逆,可知c2(NO2)=c2(NO)c(O2),T2时化学平衡常数K等于1,大于0.8,且该反应的正反应是吸热反应,说明升高温度平衡正向移动,所以 T2>T1。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】相同温度下,分别在起始体积均为1L的两个密闭容器中发生反应:X2(g)+3Y2(g)![]() 2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
2XY3(g) △H=-akJ/mol 实验测得反应的有关数据如下表。
容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间 /min | 达到平衡过程中的能量变化 | ||
X2 | Y2 | XY3 | ||||
① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
下列叙述正确的是
A. 对于上述反应,①、②中反应的平衡常数K的数值不同
B. ①中:从开始至10min内的平均反应速率υ(X2)=0.1mol/(L·min)
C. ②中:X2的平衡转化率小于10%
D. b>0.1a
【题目】联合国将2019年定为“国际化学元素周期表年”,2018年中国化学会制作了新版周期表,包含118种元素。回答下列问题:
X | |||||||||||||||||
(1)碳元素在周期表中的位置是______。
(2)将硅的元素符号填写在上述周期表相应的空格中_______。
(3)在上述周期表中,用实线画出周期表的上方边界________。
(4)从原子结构角度解释碳化硅中碳元素显负价的原因______。
(5)第118号元素为Og(中文名“![]() ”,ào),下列说法不正确的是______。
”,ào),下列说法不正确的是______。
a.Og是第七周期0族元素 b.Og原子的核外有118个电子
c.Og在同周期元素中非金属性最强 d.中子数为179的Og核素符号是![]()
(6)已知X与Y是位于相邻周期的同主族元素。某温度下,X、Y的单质与H2化合生成气态氢化物的平衡常数分别为KX =9.7×1012、KY =5.6×107。Y是______(填元素符号),判断理由是______。
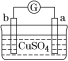
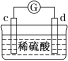
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装 置 |
|
|
|
|
部分实验现象 | a极质量减小;b极质量增加 | b极有气体产生;c极无变化 | d极溶解;c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c