题目内容
13.某消毒液的主要成分为NaClO,还含有一定量的NaOH.下列用来解释事实的方程式中,不合理的是(已知:饱和NaClO溶液的pH约为11)( )| A. | 该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-═ClO-+Cl?+H2O | |
| B. | 该消毒液的pH约为12:ClO-+H2O?HClO+OH-? | |
| C. | 该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ClO-═HClO+CH3COO-? |
分析 某消毒液的主要成分为NaClO,还含有一定量的NaOH,应为氯气和氢氧化钠反应生成,为84消毒液,含有NaClO,可在酸性条件下与氯离子发生氧化还原反应生成氯气,以此解答该题.
解答 解:A.消毒液的主要成分为NaClO,还含有一定量的NaOH,应为氯气和氢氧化钠反应生成,故A正确;
B.饱和NaClO溶液的pH约为11,而消毒液的pH约为12,因此溶液的pH主要不是由ClO-的水解造成的,氢氧化钠过量,为溶液呈碱性的主要原因,故B错误;
C.在酸性条件下与氯离子发生氧化还原反应生成氯气,发生2H++Cl-+ClO-═Cl2↑+H2O,故C正确;
D.由于HClO酸性较弱,则NaClO可与醋酸反应生成HClO,漂白性增强,故D正确.
故选B.
点评 本题为2015年北京考题,以氯气为载体综合考查元素化合物知识,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
3.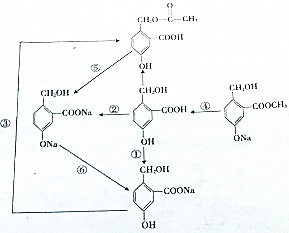 如图所示为某有机物的转化关系.完成表格.
如图所示为某有机物的转化关系.完成表格.
 如图所示为某有机物的转化关系.完成表格.
如图所示为某有机物的转化关系.完成表格.| 转化序号 | 需加入的反应物及反应条件 |
| ① | |
| ② | |
| ③ | |
| ④ | |
| ⑤ | |
| ⑥ |
2.研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 .
.
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).

①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液PH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
①HSO3-的电离平衡常数表达式K=$\frac{c({H}^{+})c(S{{O}_{3}}^{2-})}{c(HS{{O}_{3}}^{-})}$.
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
(1)①硫离子的结构示意图为
 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发).

①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液PH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
20.下列反应中,反应后固体物质增重的是( )
| A. | 氢气通过灼热的氧化铜粉末 | B. | 二氧化碳通过过氧化钠粉末 | ||
| C. | 铝与氧化铁发生铝热反应 | D. | 将锌粒投入硝酸铜溶液中 |
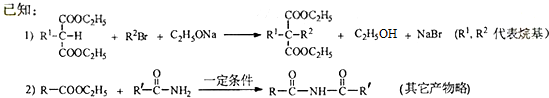
 )偶联可用于制备药物Ⅱ:
)偶联可用于制备药物Ⅱ: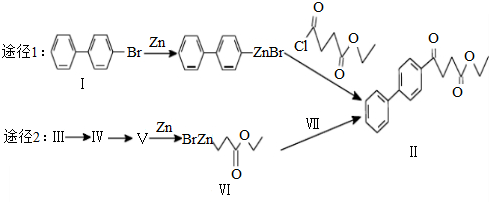
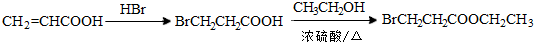 .(标明反应试剂,忽略反应条件).
.(标明反应试剂,忽略反应条件).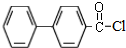 .
.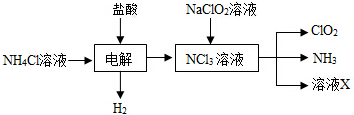



 $→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D
$→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D
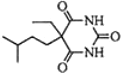
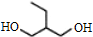 +2NaBr.
+2NaBr.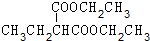 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→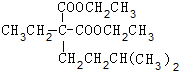 +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr.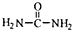 .
. .
.