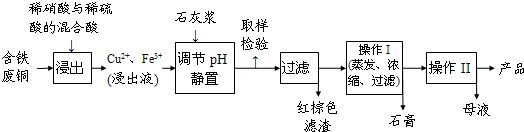
题目内容
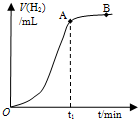 (2009?徐汇区二模)某学生用质量为a g、边长为b cm的正方形镀锌铁片与过量盐酸反应测定镀层厚度,并将实验结果绘图示意,反应完毕后铁片质量为c g(已知锌的密度为ρ g/cm3).下列叙述错误的是( )
(2009?徐汇区二模)某学生用质量为a g、边长为b cm的正方形镀锌铁片与过量盐酸反应测定镀层厚度,并将实验结果绘图示意,反应完毕后铁片质量为c g(已知锌的密度为ρ g/cm3).下列叙述错误的是( )分析:A、锌比铁活泼,在盐酸中,Zn与Fe构成原电池,反应速率减慢,当反应速率显著减小时,说明Zn与盐酸反应完成.
B、根据题意可知锌的质量为(a-c)g,根据m=ρV计算出锌的体积,体积除以锌的面积即得锌镀层的厚度.
C、反应放热,温度升高反应速率加快,故反应中段速率加快.
D、在盐酸中,Zn与Fe构成原电池,锌比铁活泼,锌为负极,Zn失去电子被氧化.
B、根据题意可知锌的质量为(a-c)g,根据m=ρV计算出锌的体积,体积除以锌的面积即得锌镀层的厚度.
C、反应放热,温度升高反应速率加快,故反应中段速率加快.
D、在盐酸中,Zn与Fe构成原电池,锌比铁活泼,锌为负极,Zn失去电子被氧化.
解答:解:A、在盐酸中,Zn与Fe构成原电池,因为Zn的活泼性比Fe的强,Zn失去电子被氧化,随着Zn的消耗,原电池作用减弱,反应速率减慢,当反应速率显著减小时,说明Zn与盐酸反应完成,故A正确;
B、根据题意可知锌的质量为(a-c)g,锌的密度为ρ g/cm3,所以锌的体积为
=
cm3,边长为b cm的正方形镀锌铁片,所以锌片面积为2b2cm2,所以锌镀层的厚度为
=
cm,故B错误;
C、反应中段速率加快,说明反应放热使OA段的反应速率,故C正确;
D、在盐酸中,Zn与Fe构成原电池,锌比铁活泼,锌为负极,Zn失去电子被氧化,电极反应式为Zn-2e-═Zn2+,故D错误.
故选:BD.
B、根据题意可知锌的质量为(a-c)g,锌的密度为ρ g/cm3,所以锌的体积为
| (a-c)g |
| ρ g/cm3 |
| a-c |
| ρ |
| ||
| 2b2cm2 |
| a-c |
| 2ρb2 |
C、反应中段速率加快,说明反应放热使OA段的反应速率,故C正确;
D、在盐酸中,Zn与Fe构成原电池,锌比铁活泼,锌为负极,Zn失去电子被氧化,电极反应式为Zn-2e-═Zn2+,故D错误.
故选:BD.
点评:考查原电池的应用、电极反应式书写、反应速率影响因素、有关计算,难度较大,关键是清楚测量原理,当反应速率显著减小时,说明Zn与盐酸反应完成.B选项为易错点,容易把锌片面积按b2cm2计算,忽略铁片是两面镀锌.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目