题目内容
【题目】下列说法中正确的是
A. NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构
B. PH3和CH4都是正四面体形分子且键角都为109°28′
C. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
D. NH4+的电子式为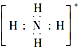 ,离子呈平面正方形结构
,离子呈平面正方形结构
【答案】C
【解析】A.二氧化氮分子中,N元素位于第VA族,则5+2=7,所以不满足8电子稳定结构,二氧化硫分子中,S元素位于第VIA族,则6+2=8,所以满足8电子稳定结构,三氟化硼分子中,B元素位于第IIIA族,则3+3=6,所以不满足8电子稳定结构,三氯化氮分子中,氮原子为有第VA族,则5+3=8,所以满足8电子结构,故A错误;B.PH3和NH3的结构相似,为三角锥形,故B错误;C.分子中,孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力,所以NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强,故C正确;D.铵根离子和甲烷分子结构相似,都是正四面体结构,故D错误;故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目